Estructura de los Aminoácidos
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos
para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos
comunes, estándar o normales.
Los aminoácidos se llaman así porque son derivados aminados de ácidos carbonos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido.
[El nombre químico correcto, o nombre sistemático, se apega a reglas establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC, de International Union of Pure and Applied Chemistry) y la Unión Internacional de Bioquímica y Biología Molecular (IUBMB, de International Union of Biochemistry and Molecular Biology))
En 19 de los 20 aminoácidos que se usan en la biosíntesis de proteínas, el átomo de carbono a es quiral, o asimétrico, porque tiene cuatro grupos diferentes unidos a él. La excepción es la glicina, cuyo grupo R sólo es un átomo de hidrógeno (la molécula no es quiral, porque el átomo de carbono a está unida a dos átomos idénticos de hidrógeno). Los 19 aminoácidos quirales pueden, en consecuencia, existir como estereoisómeros. Los estereoisómeros son compuestos que tienen la misma fórmula molecular pero difieren en el orden o configuración de sus átomos en el espacio.
Por convención, los pares de imágenes especulares de aminoácidos se indican como:
Las estructuras de los 20 aminoácidos que suelen encontrarse en las proteínas como proyecciones de Fischer. Las propiedades de las cadenas laterales tienen gran influencia sobre la forma tridimensional
general, o conformación, de una proteína.
En las figuras se usan las abreviaturas de tres y de una letra para indicar cada aminoácido. La abreviatura de tres letras es evidente (en inglés), pero la abreviatura simple de una letra es menos obvia. Varios aminoácidos comienzan con la misma letra, de modo que se deben usar otras letras del alfabeto para tener una designación adecuada; por ejemplo, treonina T, tirosina Y y triptófano W. Estos identificadores se deben memorizar. Es importante aprenderse las estructuras de los aminoácidos estándar porque se enzimas y síntesis de proteínas.
Las cadenas laterales pertenecen a las siguientes clases químicas: alifática, aromática, sulfurada, alcohol, base, ácido y amida. De los 20 aminoácidos, cinco se subdividen en
muy (o altamente) hidrofóbicos (en gris claro) y siete se clasifican como muy hidrofílicos (en negro). Comprender la clasificación de los grupos R simplificará la memorización de las estructuras y los nombres.
Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral.
Grupos R aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromático Los tres aminoácidos aromáticos absorben luz ultravioleta (UV) porque, a diferencia de los aminoácidos alifáticos:
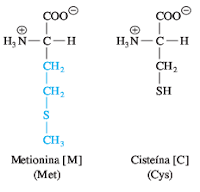
. Grupos R sulfurados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos
.
Cadenas laterales con grupos alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas.
Grupos R básicos
Grupos R ácidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7.
Hidrofobicidad de las cadenas laterales de aminoácidos
Las diversas cadenas laterales en los aminoácidos van desde muy hidrofóbicas hasta muy hidrofílicas pasando por débilmente polares. La hidrofobicidad o hidrofilicidad (o hidrofilia) relativas de cada aminoácido se llama hidropatía.
Otros aminoácidos y derivados de aminoácidos
 En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies.
En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies.
Ionización de los aminoácidos
Las propiedades físicas de los aminoácidos reciben influencias de los estados iónicos de los grupos a-carboxilo y a-amino y de todos los grupos ionizables que haya en las cadenas laterales. Cada grupo ionizable guarda relación con un valor específico de pKa que corresponde al pH al que son iguales las concentraciones de las formas protonada y no protonada. Cuando el pH de la solución es menor que el pKa. predomina la forma protonada y el aminoácido es entonces un ácido real, capaz de donar un
protón. El pKa de un grupo ionizable corresponde a un punto medio en su curva de titulación.
Unión de aminoácidos por enlaces peptídicos en las proteínas
La secuencia lineal de aminoácidos en una cadena polipeptídica se llama estructura primaria de una proteína. A los niveles más altos de estructura se les llaman estructura secundaria, terciaria y cuaternaria. El enlace que se forma entre los aminoácidos es un enlace de amida y se llama enlace peptídico, o enlace de péptido.
Técnicas de purificación de las proteínas
Para estudiar determinada proteína en el laboratorio, en general se debe separar de todos los demás componentes celulares, incluyendo a otras proteínas parecidas. Se pueden aplicar pocas técnicas analíticas en forma directa a las mezclas crudas de proteínas celulares porque contienen cientos (o miles) de proteínas diferentes.
Entre las técnicas tenemos:
- Cromatografía de intercambio iónico
- Cromatografía por filtración en gel
- La cromatografía de afinidad
Técnicas analíticas
- Electroforesis en gel de poliacrilamida
- La espectrometría de masas
- Espectrometría de masas por Eectroaspersión
Bibliografía: Principios de la Bioquímica, cuarta edición , horton.










No hay comentarios:
Publicar un comentario