Una conformación es un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes.
Una conformación es un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes.
Una proteína puede ser una sola cadena polipeptídica o puede estar formada por
varias de esas cadenas unidas entre sí por interacciones débiles.
El estudio de grandes conjuntos de proteínas, como el de todo el complemento de proteínas producidas por una célula, es parte de un campo emergente llamado proteómica.
Las proteínas tienen diversas formas. Muchas son macromoléculas aproximadamente esféricas, hidrosolubles y compactas cuyas cadenas polipeptídicas están dobladas de manera apretada. Esas proteínas globulares tienen un interior hidrofóbico y una superficie hidrofílica.
También los polipéptidos pueden ser partes de grandes estructuras subcelulares o extracelulares, como ribosomas, flagelos y cilios, músculos y cromatina. Las proteínas fibrosas son una clase particular de proteínas estructurales que proporcionan soporte mecánico a las células u organismo.
Hay cuatro niveles de estructura de las proteínas
La estructura secundaria se refiere a las regularidades en las conformaciones locales mantenidas por puentes de hidrógeno entre los hidrógenos de amida y los oxígenos de carbonilo en la columna vertebral del péptido. Las estructuras secundarias principales son las hélices a y las hebras b (incluyendo las láminas a). Las moléculas individuales de proteína se pueden describir mediante hasta cuatro niveles de estructura , la estructura primaria describe la secuencia lineal de residuos de aminoácidos en una proteína, La estructura tridimensional de una proteína se describe con tres niveles adicionales: estructura secundaria, estructura terciaria y estructura cuaternaria.
Métodos para determinar la estructura de las proteínas
Como la degradación de Edman, o en forma indirecta, a partir de la secuencia del gen. La técnica acostumbrada para determinar la conformación tridimensional de una proteína es la cristalografía con rayos X. En esta técnica se apunta un haz de rayos X colimados, o paralelos, a un cristal de moléculas de proteína. Los electrones en el cristal difractan los rayos X, que se registran entonces en una película, o mediante un detector electrónico.
El análisis matemático de la figura de difracción produce una imagen.

Conformación del grupo peptídico
Debido a la naturaleza del doble enlace en el enlace peptídico, la conformación del grupo peptídico se restringe a una de dos conformaciones posibles, que puede ser trans o cis. En la conformación trans, los dos carbonos a de residuos adyacentes de aminoácido están en lados opuestos del enlace peptídico y en las esquinas opuestas del rectángulo que forma el grupo peptídico plano. En la conformación cis, los dos carbonos a están en el mismo lado del enlace peptídico y están más cerca entre sí.
La conformación cis es menos favorable que la conformación trans, que
En consecuencia, casi todos los grupos peptídicos en las proteínas tienen la conformación trans.
Hebras b y láminas b
La otra estructura secundaria común se llama estructura b, una clase que incluye a hebras b y láminas b. Las hebras B son partes de la cadena polipeptídica que se encuentran casi totalmente extendidas. Cada residuo en una hebra b ocupa de 0.32 a 0.34 nm de la longitud total, en contraste con la espiral compacta de una hélice a, donde cada residuo corresponde a 0.15 nm de la longitud general. Cuando se ordenan varias hebras b lado a lado forman láminas B, estructura que propusieron originalmente Pauling y Corey cuando desarrollaban el modelo teórico de la hélice
Estructuras secundarias
Las estructuras secundarias, o motivos, son combinaciones reconocibles de hélices a, hebras b y giros que aparecen en diversas proteínas. A veces los motivos se relacionan con determinada función, aunque los motivos de estructura similar pueden tener funciones distintas en proteínas diferentes.
Dominios
Hay muchas proteínas que están formadas por varias unidades compactas, discretas, plegadas en forma independiente llamadas dominios. Los dominios pueden consistir en combinaciones de motivos. El tamaño de un dominio varía desde unos 25 a 30 residuos de aminoácidos hasta más de 300.
En la célula se sintetizan nuevos polipéptidos por un complejo de traducción que incluye ribosomas, ARNm y varios factores mas.
El efecto hidrofóbico
Las proteínas son más estables en agua cuando sus cadenas laterales hidrofóbicas se agrupan en el interior de la proteína y no quedan expuestas al medio acuoso en la superficie. Como las moléculas de agua interaccionan con más fuerza entre sí que con las cadenas laterales no polares de una proteína, estas cadenas son impulsadas a vincularse entre sí, lo cual determina que la cadena polipeptídica se colapse y forme un glóbulo fundido más compacto.
Puentes de hidrógeno
Los puentes de hidrógeno contribuyen a la cooperatividad del plegamiento y ayudan a estabilizar las conformaciones nativas de las proteínas. Los primeros puentes de hidrógeno son los que se forman en las hélices a, las láminas b y los giros, y forman regiones definidas de la estructura secundaria.
La colágena, una proteína fibrosa
Las proteínas seleccionadas para estudiar con más detalle son la colágena,
una proteína estructural, la mioglobina y la hemoglobina, proteínas que unen oxígeno y los anticuerpos. La colágena es la principal proteína componente del tejido conectivo de los vertebrados; constituye de 25 a 35% de las proteínas totales en los mamíferos. Las moléculas de colágena tienen formas y funciones notablemente distintas.
Estructuras de la mioglobina y la hemoglobina
Como la mayor parte de las proteínas, la mioglobina (Mb) y la hemoglobina (Hb), una proteína relacionada, desempeñan sus funciones biológicas al unirse en forma selectiva y reversible a otras moléculas —en este caso, al oxígeno molecular (O2).
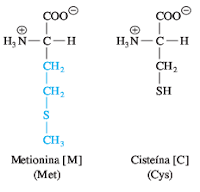
El interior de la mioglobina está formado en forma casi exclusiva por residuos hidrofóbicos de aminoácidos, en especial los que son muy hidrofóbicos como valina, leucina, isoleucina, fenilalanina y metionina. La superficie de la proteína contiene residuos tanto hidrofílicos como hidrofóbicos.
Los anticuerpos se unen a antígenos específicos
Los vertebrados poseen un sistema inmunitario complicado que elimina sustancias extrañas como bacterias y virus infecciosos. Como parte de este sistema de defensa, los vertebrados sintetizan las proteínas llamadas anticuerpos (llamadas también inmunoglobulinas), que reconocen y se unen en forma específica con antígenos). Los anticuerpos son proteínas de multidominio que se unen con sustancias extrañas o antígenos marcándolas para su destrucción. Los dominios variables en los extremos de las cadenas pesadas y ligeras interactúan con el antígeno.
Bibliografía: Principios de Bioquímica,cuarta edición, Horton