más abundante de moléculas biológicas en la Tierra. Aunque todos los organismos
pueden sintetizar carbohidratos, muchos de ellos se producen en organismos fotosintéticos, como bacterias, algas y plantas. Estos organismos convierten la energía solar en energía química, que a continuación se usa para fabricar carbohidratos a partir de
dióxido de carbono. Los carbohidratos tienen varios papeles fundamentales en los organismos vivos. En animales y plantas, los carbohidratos poliméricos funcionan como moléculas almacenadoras de energía. Los animales pueden ingerir carbohidratos, que a continuación se puedan oxidar para obtener energía para los procesos metabólicos. También se encuentran carbohidratos poliméricos en las paredes celulares y en los recubrimientos protectores de muchos organismos; otros carbohidratos polímeros son moléculas marcadoras que permiten que un tipo de célula reconozca e interaccione con otro tipo.
Se pueden describir los carbohidratos por la cantidad de unidades monómeras que contienen. Los monosacáridos son las unidades más pequeñas de estructura de carbohidratos. El nombre carbohidrato, “hidrato de carbono”, indica que su fórmula empírica es (CH2O)n en donde n es 3 o más (en general n es 5 o 6, pero puede ser hasta 9). Los oligosacáridos son polímeros con dos hasta unos 20 residuos de monosacárido. Los oligosacáridos más comunes son los disacáridos, formados por dos residuos de monosacárido unidos.
Los polisacáridos son polímeros que contienen muchos (en general más de 20) residuos de monosacáridoLa mayor parte de los compuestos quirales.
Los monosacáridos son sólidos blancos, cristalinos y solubles en agua que tienen sabor
dulce. Entre los ejemplos están la glucosa y la fructosa. Desde el punto de vista químico,
los monosacáridos son polihidroxi aldehídos o aldosas, o polihidroxi cetonas o cetosas.
Se clasifican por el tipo de grupo carbonilo y por la cantidad de átomos de carbono.
Como regla, se usa el sufijo -osa para dar nombre a los carbohidratos, aunque hay varias
excepciones. Todos los monosacáridos tienen al menos tres átomos de carbono. Uno de
ellos es el carbono carbonílico, y cada uno de los restantes tiene un grupo hidroxilo.
---- Los monosacáridos más pequeños son triosasazúcares con tres carbonos la triosa aldehídica, o aldotriosa, es el gliceraldehído.
----La triosa cetónicao cetotriosaes la dihidroxiacetona
La convención de designar a los isómeros como D y L se basó originalmente en las propiedades ópticas del gliceraldehído.
La forma del gliceraldehído que causaba la rotación hacia la derecha (dextrorrotatoria)
se designó como D; la que causaba la rotación hacia la izquierda (levorrotatoria) se designó como L.
Se puede considerar que las aldosas y las cetosas más largas son prolongaciones del gliceraldehído y la dihidroxiacetona, respectivamente, y que los grupos quirales.
Cuando las moléculas de azúcar tienen distinta configuración sólo en uno de varios centros quirales, se llaman epímeros. Por ejemplo, la D-manosa y la D-galactosa son epímeros de la D-glucosa.
Ciclación de aldosas y hexosas
El comportamiento óptico de algunos monosacáridos parece indicar que tienen un átomo de carbono más que lo que se ve en las estructuras.
La causa de esta asimetría adicional es una reacción de ciclación intramolecular, produce un nuevo centro quiral en el átomo de carbono del grupo carbonilo.
Como se parece al compuesto heterocíclico pirano, de seis miembros (figura 8.7a), al anillo con seis miembros de un monosacárido se le llama piranosa. Cómo el anillo con cinco miembros de un monosacárido se parece al del furano, se le llama furanosa.
El carbono más oxidado de un monosacárido ciclado, el que está unido a dos átomos de oxígeno, se llama carbono anomérico.
Derivados de los monosacáridos
Entre estos derivados están los monosacáridos polimerizados, como los oligosacáridos y los polisacáridos, igual que varias clases de compuestos no polimerizados. En esta sección se presentarán algunos derivados de monosacárido, incluyendo fosfatos de azúcar, desoxi y aminoazúcares, azúcares alcoholes, azúcares ácidos y el
ácido ascórbico (vitamina C).
Igual que otras biomoléculas formadoras de polímeros, los monosacáridos y sus
derivados tienen abreviaturas con las que se describen los polisacáridos más complejos.
Las abreviaturas aceptadas tienen tres letras, y en algunos casos.
Fosfatos de azúcar
Los monosacáridos, en las vías metabólicas, con frecuencia se convierten en ésteres de
fosfato
Desoxiazúcares:
En esos derivados, un átomo de hidrógeno sustituye a uno de los grupos hidroxilo del monosacárido
precursor. La 2-desoxi-D-ribosa es un bloque constructivo importante en el ADN. La
L-fucosa (6-desoxi-L-galactosa) está muy distribuida en plantas, animales y microorganismos.
Aminoazúcares
En varios azúcares, un grupo amino sustituye uno de los grupos hidroxilo del monosacárido precursor. A veces el grupo amino está acetilado
Azúcares alcoholes
En un azúcar alcohol el oxígeno carbonílico del monosacárido precursor se ha reducido
y se produce un polihidroxialcoholes.
Azúcares ácidos
Ácido ascórbico
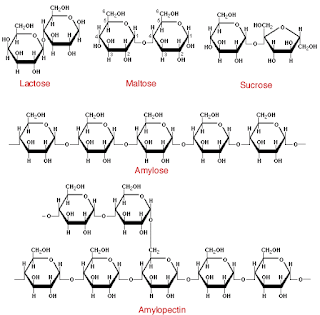
Disacáridos y otros glicósidos
El enlace glicosídico es el principal enlace estructural en todos los polímeros de los monosacáridos. Es un enlace acetal, donde el carbono anomérico de un azúcar se condensa con un alcohol, una amina o un tiol. Por ejemplo, la glucopiranosa puede reaccionar con metanol en solución ácida, para formar un acetal (figura 8.19). Los compuestos que tienen enlaces glicosídicos se llaman glicósidos. Los glucósidos son una clase especial de glicósidos, donde la glucosa aporta el carbono anomérico. Entre los glicósidos hay disacáridos, polisacáridos y algunos derivados de carbohidrato.
Azúcares reductores y no reductores
Como los monosacáridos y la mayor parte de los disacáridos son hemiacetales y enconsecuencia contienen un grupo carbonilo reactivo, se oxidan con facilidad y forman productos diversos, propiedad que se usa con frecuencia para analizarlos. Esos carbohidratos, incluyendo glucosa, maltosa, celobiosa y lactosa, se llaman a veces azúcares reductores. Los azúcares reductores se detectaban por su capacidad de reducir iones
metálicos, como o Ag y formar productos insolubles. Los carbohidratos queson acetales, como la sacarosa, no se oxidan con facilidad, porque ambos átomos de carbono anoméricos están fijos en un enlace glicosídico. Se clasifican como azúcares no reductores.
La capacidad reductora de un azúcar polímero tiene interés más que analítico. Las
cadenas poliméricas de los oligosacáridos y polisacáridos tienen direccionalidad, conbase en sus extremos reductores y no reductor.
Polisacáridos
Los homoglicanos (u homopolisacáridos) son polímeros que sólo contienen residuos de un tipo de monosacárido. Los heteroglicanos (o heteropolisacáridos) son polímeros que contienenresiduos de más de un tipo de monosacárido.
Almidón y glucógeno
Todas las especies sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir energía metabólica.
Celulosa y quitina
La celulosa es un polisacárido estructural. Es uno de los principales componentes de las paredes celulares rígidas que rodean muchas células vegetales. Los tallos y las ramas de muchas plantas están formados principalmente por celulosa. Este solo polisacárido forma un porcentaje apreciable de toda la materia orgánica en la Tierra. Igual que la amilosa, la celulosa es un polímero lineal de residuos de glucosa, pero en la celulosa esos.
Glicoconjugados:
Los glicoconjugados consisten en polisacáridos unidos a (conjugados con) proteínas o péptidos. En muchos casos, los polisacáridos consisten en varias unidades distintas demonosacárido. Por consiguiente, son heteroglicanos. (Almidón, glucógeno, celulosa y quitina son homoglicanos). Los heteroglicanos aparecen en tres tipos de glicoconjugados: proteoglicanos, peptidoglicanos y glicoproteínas.
Proteoglicanos
Los proteoglicanos son complejos de proteínas y una clase de polisacáridos llamados glicosaminoglicanos. Esos glicoconjugados se presentan principalmente en la matriz extracelular (tejido conectivo) de animales multicelulares. Los glicosaminoglicanos son heteroglicanos no ramificados de unidades repetitiva.
Peptidoglicanos
Los peptidoglicanos son polisacáridos unidos a péptidos pequeños. Las paredes celulares
de muchas bacterias contienen una clase especial de peptidoglicano con un componente de heteroglicano unido a un péptido de cuatro o cinco residuos. El componente heteroglicano está formado por residuos alternados de GlcNAc y ácido N-acetilmurámico
(MurNAc
Glicoproteínas
Las glicoproteínas, como los proteoglicanos, son proteínas que contienen oligosacáridos unidos en forma covalente (es decir, proteínas que están glicosiladas; los proteoglicanos son un tipo de glicoproteína). Las cadenas de carbohidrato de una glicoproteína
varían de longitud, de 1 hasta más de 30 residuos, y pueden formar hasta 80% de la masa total de la molécula.
Medicamentos que contenga Hidratos de Carbono
FLEBOPLAST LEVULOSA GRIFOLS
FLEBOPLAST LEVULOSA GRIFOLS Sol. iny. 5% env. con 250 ml
Clase terapéutica: Sangre
y derivados
Principios activos: Fructosa
ATC: Carbohidratos
Laboratorio: GRIFOLS
Fleboplast Glucosalina Grifols pertenece al grupo de
soluciones intravenosas que afectan el balance
electrolítico.
Fleboplast Glucosalina Grifols está indicada en:
- Estados de deshidratación (pérdida de agua corporal) con
pérdidas moderadas de electrolitos
- Alteraciones del metabolismo hidrocarbonado
- Estados de alcalosis leves
- Como vehículo para la administración de medicamentos y
electrolitos.
POSIBLES EFECTOS ADVERSOS:
Al igual que todos los medicamentos, Fleboplast Glucosalina
Grifols puede producir efectos adversos,
aunque no todas las personas los sufran.
Si la administración de la solución se realiza de forma
correcta y controlada, las únicas complicaciones
posibles son las derivadas de la técnica de administración
por vía intravenosa, que incluyen fiebre,
infección en la zona de inyección, dolor, reacción y/o
irritación en la zona de inyección, trombosis
venosa o flebitis que se extiende desde el lugar de la
inyección y extravasación.
Composición de Fleboplast Glucosalina Grifols:
Los principios activos son la glucosa y el cloruro de sodio. Cada 100 ml de solución contienen 3,3 g
de glucosa (como monohidrato) y 0,3 g de cloruro de sodio.
Los demás componentes son: ácido clorhídrico (para ajuste de pH) y agua para preparaciones
inyectables.
SUERO LEVULOSADO BIEFFE MEDITAL CLEAR FLEX
Sol. iny. 5% env. con 20 bolsas de 500 ml
| Clase terapéutica: | Sangre y derivados |
| Principios activos: | Fructosa |
| ATC: | Carbohidratos |
| Laboratorio: | BAXTER |
Sangre y órganos hematopoyéticos > Sustitutos de sangre y soluciones para perfusión > Soluciones IV > Soluciones para nutrición parenteral.
GLUCOSA IFE Sol. para perfusión 10 % env. con 10x1000 ml
| Clase terapéutica: | Sangre y derivados |
| Principios activos: | Glucosa monohidratada |
| ATC: | Carbohidratos |
| Laboratorio: | INSTITUTO FARMACOLOGICO ESPAÑOL |
| Enfermedades: Tratamientos |
Nutrición parenteral , Vehículo para administración de
medicamentos y electrolitos , Alteraciones del metabolismo de hidratos de
carbono , Deshidratación hipertónica
|