BIENVENIDOS (A)
"La ciencia debe ser lo más
sencilla posible, pero no
más simple"
—Albert Einstein
La bioquímica es el estudio de las moléculas y las reacciones químicas de la vida.
Es la disciplina que emplea los principios y el lenguaje de la química a fin de explicar la biología a nivel molecular. Los bioquímicos descubrieron que los compuestos químicos y los procesos metabólicos centrales son los mismos que se encuentran en organismos tan distantes como las bacterias, plantas y humanos.
Muchos estudiantes e investigadores están cada vez más interesados en la bioquímica humana. Las causas de la enfermedad y la importancia de la nutrición apropiada, por ejemplo, son temas bioquímicos fascinantes.
1.1 La bioquímica es una ciencia moderna
La bioquímica surgió como ciencia dinámica tan sólo desde hace 100 años.El crecimiento de la bioquímica y su influencia en otras disciplinas seguirá su marcha durante el siglo XXI.
Los dos descubrimientos más importantes en la historia de la bioquímica son especialmente notables: el descubrimiento de la función catalítica de las enzimas y la función de los ácidos nucleicos como moléculas transportadoras de información.
1.2 Los elementos químicos de la vida
Las reacciones bioquímicas incluyen uniones químicas específicas o partes de moléculas denominadas grupos funcionales.Una cuestión importante para la bioquímica es que las reacciones químicas que
ocurren dentro de la célula son similares a las reacciones que tienen lugar en un laboratorio químico. La diferencia más importante radica en que casi todas las reacciones que ocurren en las células vivas son catalizadas por enzimas y por lo tanto ocurren a velocidades muy altas.
Con frecuencia, los investigadores encuentran útil distinguir entre las reacciones bioquímicas que
tienen lugar en un organismo (in vivo) y aquellas que ocurren bajo condiciones de laboratorio (in vitro)
Muchas macromoléculas importantes son polímeros
Las macromoléculas tienen propiedades que son muy diferentes de las de sus monómeros constitutivos. Las principales macromoléculas son:
 Proteínas: Son veinte los aminoácidos comunes que forman parte de las proteínas de todas las células. Cada aminoácido contiene un grupo amino y un grupo carboxilato, así como una cadena lateral (grupo R) que es única para cada aminoácido.
Proteínas: Son veinte los aminoácidos comunes que forman parte de las proteínas de todas las células. Cada aminoácido contiene un grupo amino y un grupo carboxilato, así como una cadena lateral (grupo R) que es única para cada aminoácido.
Polisacáridos
El término “lípido” se refiere a una clase diversa de moléculas ricas en carbono e hidró-geno pero que contienen relativamente pocos átomos de oxígeno. La mayor parte de los lípidos no es soluble en agua, pero se pueden disolver en algunos solventes orgánicos.Los lípidos más simples son los ácidos grasos, que son hidrocarburos de cadena larga con un grupo carboxilato en un extremo. De manera habitual los ácidos grasos que son hidrocarburos de cadena larga con un grupo carboxilato en un extremo. ejemplo de lípidos: glicerofosfolipidos, esteroides (colesterol) y las ceras,
Muchas veces los lípidos cuentan con una cabeza polar e hidrofílica (amante del agua) que puede interactuar con un entorno acuoso, y una cola no polar e hidrofóbica (temerosa del agua). En un entorno acuoso, las colas hidrofóbicas de tales lípidos se asocian para producir una hoja denominada bicapa lipídica. Las bicapas lipídicas forman la base estructural de todas las membranas biológicas.
Velocidades de reacción y equilibrios
La velocidad, o aceleración, de una reacción química depende de la concentración de los reactivos. Considérese una reacción química simple donde la molécula A colisione con la molécula B y experimente una reacción que genere los productos C y D.
Células procarióticas: características estructurales
Por lo general los procariotas son organismos unicelulares. De todos los organismos vivos el que mejor se ha estudiado es la bacteria Escherichia coli.
Células eucarióticas:
Los eucariotas incluyen plantas, animales, hongos y protistas. Los protistas son en su mayoría organismos pequeños y unicelulares que no encajan en alguna de las demás clases. Las células eucarióticas están rodeadas por una membrana plasmática única.
 Proteínas: Son veinte los aminoácidos comunes que forman parte de las proteínas de todas las células. Cada aminoácido contiene un grupo amino y un grupo carboxilato, así como una cadena lateral (grupo R) que es única para cada aminoácido.
Proteínas: Son veinte los aminoácidos comunes que forman parte de las proteínas de todas las células. Cada aminoácido contiene un grupo amino y un grupo carboxilato, así como una cadena lateral (grupo R) que es única para cada aminoácido.
Muchas proteínas funcionan como enzimas; otras son componentes estructurales de células y organismos. La forma tridimensional de una proteína está determinada en gran parte por la secuencia de sus residuos de aminoácidos. La función de una proteína depende de su estructura tridimensional, o conformación.
Polisacáridos
Los carbohidratos, o sacáridos, están compuestos principalmente por carbono, oxígeno e hidrógeno. Este grupo de componentes incluye azúcares simples (monosacáridos) así como sus polímeros (polisacáridos).
Ácidos nucleicos: Los ácidos nucleicos son grandes macromoléculas compuestas por monómeros llamados nucleótidos. Los nucleótidos están compuestos por un azúcar de cinco carbonos una base nitrogenada heterocíclica y al menos un grupo fosfato. Las bases nitrogenadas de los nucleótidos corresponden a dos familias conocidas como purinas y pirimidinas. Las principales purinas son adenina (A) y guanina (G), las principales pirimidinas son citosina (C), timina (T) y uracilo (U)
En el ADN, las bases de dos hebras de polinucleótidos diferentes interactúan para formar una estructura helicoidal. Posee un azúcar desoxirribosa.
El ARN contiene ribosa en lugar de desoxirribosa y por lo general es un polinucleótido de una sola hebra. Existen tres clases de moléculas de ARN. El ARN mensajero (ARNm) está implicado directamente en la transferencia de información del ADN a la proteína. El ARN de transferencia (ARNt) es una molécula más pequeña requerida para la síntesis de proteínas. El ARN ribosómico (ARNr) es el principal componente de los ribosomas.
Lípidos y membranas
Muchas veces los lípidos cuentan con una cabeza polar e hidrofílica (amante del agua) que puede interactuar con un entorno acuoso, y una cola no polar e hidrofóbica (temerosa del agua). En un entorno acuoso, las colas hidrofóbicas de tales lípidos se asocian para producir una hoja denominada bicapa lipídica. Las bicapas lipídicas forman la base estructural de todas las membranas biológicas.
Velocidades de reacción y equilibrios
La velocidad, o aceleración, de una reacción química depende de la concentración de los reactivos. Considérese una reacción química simple donde la molécula A colisione con la molécula B y experimente una reacción que genere los productos C y D.
A + B ----->C + D
Termodinámica
Si se conocen los cambios de energía vinculados a una reacción o proceso es posible predecir las concentraciones en equilibrio. También se puede predecir la dirección de la reacción siempre que se conozcan las concentraciones iniciales de reactivos y productos. La cantidad termodinámica que proporciona esta información es la energía libre de Gibbs (G).
La célula es la unidad básica de la vida
Todos los organismos son unicelulares o están compuestos por muchas células. Las células existen en una variedad extraordinaria de tamaños y formas, pero todas se pueden clasificar como eucarióticas o procarióticas. Una sola célula simple puede ser representada como una gota de agua rodeada por una membrana plasmática.Células procarióticas: características estructurales
Por lo general los procariotas son organismos unicelulares. De todos los organismos vivos el que mejor se ha estudiado es la bacteria Escherichia coli.
Los eucariotas incluyen plantas, animales, hongos y protistas. Los protistas son en su mayoría organismos pequeños y unicelulares que no encajan en alguna de las demás clases. Las células eucarióticas están rodeadas por una membrana plasmática única.
La bioquímica es multidisciplinaria
Una de las metas de los bioquímicos es integrar un gran cuerpo de conocimiento para conformar una explicación molecular de la vida. Esto ha sido, y continúa siendo, una tarea desafiante. Sin embargo, los bioquímicos han realizado grandes avances hacia la definición de las reacciones básicas comunes a todas las células y han entendido cómo están interrelacionadas estas reacciones.
La bioquímica como disciplina no existe en un vacío. Ya se vio cómo la física, la química, la biología celular y la evolución contribuyen a una comprensión de la bioquímica. Las disciplinas relacionadas, como la fisiología y la genética, también son importantes. De hecho, muchos científicos ya no se consideran a sí mismos simplemente biólogos sino que son reconocidos en varios campos relacionados.Como todos los aspectos de la bioquímica están interrelacionados, es difícil presentar un tema sin referirse a los demás.
El AGUA
Es probable que la vida se haya originado en el agua, hace más de tres mil millones de años, y que todas las células vivientes sigan dependiendo del agua para existir.
Algunos tipos de moléculas interaccionan en forma extensa con el agua y en consecuencia son muy solubles. Otras moléculas no se disuelven con facilidad en el agua y tienden a asociarse entre sí para evitar el agua. Gran parte de la maquinaria metabólica de las células debe operar en un ambiente acuoso porque el agua es un solvente esencial y también un sustrato de numerosas reacciones celulares. Sus propiedades físicas le permiten funcionar como solvente de sustancias iónicas y polares.
La molécula de agua es polar
- Un átomo de oxígeno tiene ocho electrones y su núcleo cuenta con ocho protones y ocho neutrones.
- La polaridad de una molécula depende tanto de la polaridad de sus enlaces covalentes como de su geometría.
Puentes de hidrógeno en el agua
 Una de las consecuencias importantes de la polaridad de la molécula de agua es que dichas moléculas se atraen entre sí. En un puente de hidrógeno entre dos moléculas de agua, el átomo de hidrógeno permanece enlazado covalentemente a su átomo de oxígeno que es el donador de hidrógeno.
Una de las consecuencias importantes de la polaridad de la molécula de agua es que dichas moléculas se atraen entre sí. En un puente de hidrógeno entre dos moléculas de agua, el átomo de hidrógeno permanece enlazado covalentemente a su átomo de oxígeno que es el donador de hidrógeno.
El agua no es la única molécula capaz de formar puentes de hidrógeno; esas interacciones pueden existir entre cualquier átomo electronegativo y un átomo de hidrógeno unido a otro átomo electronegativo. Los puentes de hidrógeno son mucho más débiles que los enlaces covalentes típicos.
Es difícil estudiar las interacciones tridimensionales del agua líquida, pero se ha aprendido mucho al examinar la estructura de los cristales de hielo. En la forma común del hielo, cada molécula de agua participa en cuatro puentes de hidrógeno, como es de esperarse.
La duración promedio de un puente de hidrógeno en el agua es más o menos de 10 picosegundos.
Propiedades Físicas
Estados físicos:
solido: que tiene un volumen y una forma definida.
liquido: materia que tiene un volumen particular
pero no una forma específica
gaseoso: materia sin forma ni volumen definidos
color : incoloro (que no posee color)
sabor: insípida (que no posee sabor)
olor: inodoro ( no posee olor)
densidad: 1 g./c.c. a 4°C (temperatura donde el agua alcanza su mayor volumen entonces es donde aquí el agua tiene el volumen de 1 cc.)
punto de congelación: 0°C ( dicho líquido se solidifica debido a una reducción de energía)
punto de ebullición: 100°C ( temperatura a la cual la presión del vapor del agua es 760 mmHg, o 1 atmósfera)
presión critica: 217,5 atm. ( campo en el que ésta puede transformarse en vapor)
Temperatura Crítica: 374°C ( temperatura límite por encima de la cual un gas miscible no puede ser licuado por compresión.
Propiedades químicas
Elevada fuerza de cohesión: ( Los puentes de hidrógeno que permanecen unidas entre sí y se establecen de forma más intensa que otros compuestos similares)
Prácticamente Incomprensible: no es fácil reducir su volumen mediante presión.
Elevada Tensión superficial: Gran resistencia a romperse, lo que permite que muchos organismos puedan “andar” sobre el agua y vivan asociados.
Capilaridad: la columna de agua a través de tubos de diámetro capilar.
Elevado Calor Específico: Un buen aislante térmico.
Bajo grado de Ionización: El pH, es neutra
Elevada Constante dieléctrico: se convierta en el gran disolvente universal. Compuestos: ionicos y polares.
Elevado Calor de Vaporización: para pasar al estado sólido parte de la energía suministrada se emplea en romper los enlaces de puentes de hidrógeno.
Presión osmótica
Si una membrana permeable al solvente separa a dos soluciones que contienen concentraciones distintas de sustancias disueltas, o solutos, las moléculas del solvente se difundirán desde la solución menos concentrada hacia la más concentrada en un proceso llamado ósmosis. La presión necesaria para evitar este flujo de solvente se llama presión osmótica.
Las sustancias no polares son insolubles en agua
Por ejemplo, las gotas diminutas de aceite que se dispersan en forma vigorosa en agua tienden a coalescer y formar una sola gota, con lo cual minimizan la superficie de contacto entre las dos sustancias.
Se dice que las moléculas no polares son hidrofóbicas (que “odian” al agua) y a este efecto de exclusión de sustancias no polares por parte del agua se le llama efecto hidrofóbico. El efecto hidrofóbico es crítico para el plegamiento de las proteínas y el autoensamblaje de las membranas biológicas.Los detergentes, a los que a veces se les llama surfactantes o agentes tensoactivos, son moléculas que son hidrofílicas e hidrofóbicas a la vez; en general cuentan con una cadena hidrofóbica de al menos 12 átomos de carbono de longitud y un extremo iónico o polar. Se dice que esas moléculas son anfipáticas.
Interacciones no covalentes
Se presentaron dos clases de interacciones no covalentes: puentes de hidrógeno e interacciones hidrofóbicas. Interacciones débiles como éstas juegan papeles de extrema importancia en las estructuras y funciones de las macromoléculas. Por ejemplo, las fuerzas débiles son las responsables de estabilizar las estructuras de las proteínas y de los ácidos nucleicos. Además de los puentes de hidrógeno y la hidrofobicidad, también hay interacciones entre carga y carga, y fuerzas de van der Waals.
Interacciones carga-carga
Las interacciones carga-carga (o entre cargas) son interacciones electrostáticas entre dos partículas cargadas. Esas interacciones son potencialmente las fuerzas no covalentes más grandes y se pueden extender a mayores distancias que otras interacciones no covalentes.
Puentes de hidrógeno:
Los puentes de hidrógeno, que también son una clase de interacción electrostática, existen en muchas macromoléculas y se encuentran entre las fuerzas no covalentes mayores en los sistemas biológicos.
Fuerzas de van der Waals:
Las interacciones electrostáticas transitorias o momentáneas causan fuerzas intermoleculares débiles entre todos los átomos neutros. Esas fuerzas de van der Waals, bautizadas en honor de Johannes Diderik van der Waals, físico holandés, sólo se producen cuando los átomos están muy cercanos entre sí. Las fuerzas de van der Waals son tanto de atracción como de repulsión. Las fuerzas de atracción, que también se llaman fuerzas de dispersión de London, se originan en el dipolo infinitesimal generado en los átomos por el movimiento aleatorio de los electrones con carga negativa en torno a los núcleos con carga positiva.
Las fuerzas de van der Waals son mucho más débiles que los puentes de hidrógeno. También hay un componente de repulsión en las fuerzas de van der Waals. Cuando dos átomos se aprietan uno contra el otro, los electrones en sus orbitales se repelen entre sí.
Interacciones hidrofóbicas
La asociación de una molécula o grupo relativamente no polar con otras moléculas no polares se llama interacción hidrofóbica. Las interacciones hidrofóbicas dependen de la mayor entropía de las
moléculas de agua vecinas, no de la atracción directa entre grupos no polares.
El agua es nucleofílica
Además de sus propiedades físicas, las propiedades químicas del agua también son importantes en bioquímica, porque las moléculas de agua pueden reaccionar con moléculas biológicas. A las sustancias ricas en electrones se les llama nucleófilos (“amantes” del núcleo) porque buscan especies con carga positiva, o con deficiencia en electrones, llamadas electrófilos (“amantes” del electrón). Los nucleófilos pueden tener carga negativa o contar con pares no compartidos de electrones. Atacan a los electrófilos durante reacciones de sustitución o de adición. Los átomos nucleófilos más comunes en biología son de oxígeno, nitrógeno, azufre y carbono.El átomo de oxígeno en el agua tiene dos pares de electrones no compartidos y por ello es nucleofílico. Aunque el agua es un nucleófilo relativamente débil, su concentración celular es tan alta que cabe esperar que muchas macromoléculas sean degradadas.
Ionización del agua
Una de las propiedades importantes del agua es su pequeña tendencia a ionizarse. El agua pura no está formada sólo por H2O, sino también por una baja concentración de iones hidronio (H3O ) y una concentración igual de iones hidróxido (OH ). Los iones hidronio e hidróxido se forman por un ataque nucleofílico del oxígeno contra uno de los protones en una molécula adyacente de agua.
La escala de pH
El pH se define como el logaritmo negativo de la concentración de H +.
Las soluciones básicas tienen valores de pH mayores que 7.0 y las soluciones ácidas tienen valores de pH menores que 7.0. Se toman mediciones exactas de valores de pH en forma rutinaria usando un medidor de pH, instrumento que tiene un electrodo de vidrio selectivamente permeable, sensible a la [H ]. A veces la medición del pH facilita el diagnóstico de las enfermedades. El valor normal de pH en la sangre humana es 7.4, que con frecuencia se llama pH fisiológico. La sangre de pacientes que padecen ciertas enfermedades, como diabetes, puede tener menor pH, condición que se llama acidosis. El estado en el que el pH de la sangre es mayor que 7.4 se llama alcalosis y puede deberse a vómitos persistentes y prolongados (pérdida de ácido clorhídrico del estómago) o a hiperventilación
(excesiva pérdida de ácido carbónico en forma de dióxido de carbono).
Constante de disociación de ácidos débiles
Los ácidos y bases que se disocian por completo en agua, como el ácido clorhídrico y el hidróxido de sodio, se llaman ácidos fuertes y bases fuertes. Hay muchos otros ácidos y bases, como por ejemplo los aminoácidos que forman las proteínas y las purinas y pirimidinas del ADN y ARN, que no se disocian por completo en el agua. A dichas sustancias se les conoce como ácidos débiles y bases débiles.
Que un ácido se definió como una molécula que puede donar un protón, y una base como un aceptador de protones. Los ácidos y las bases siempre existen en pares porque por cada donador de protón debe haber un aceptador de protón.
La constante de equilibrio
Para la disociación de un protón de un ácido en agua se llama constante de disociación del ácido,
Ecuación de Henderson-Hasselbalch
Que define al pH de una solución en función del pKa del ácido débil en el par ácido-base, y del logaritmo de la relación de las concentraciones de la especie disociada (base conjugada) entre la especie protonada (ácido débil).
Soluciones amortiguadoras
(Para resistir cambios de pH)
Si el pH de una solución permanece casi constante cuando se agregan pequeñas cantidades de ácido o base fuerte, se dice que la solución está regulada o amortiguada. La capacidad de una solución para resistir cambios de pH se llama capacidad de amortiguación. Las soluciones amortiguadoras resisten los cambios de pH. En la sangre humana el sistema amortiguador de dióxido de carbono-ácido carbónico-bicarbonato mantiene un pH constante de 7.4
Los valores de pKa de los ácidos débiles
se determinan por titulación.
Ejemplo se titula una solución de ácido
acético agregando pequeñas alícuotas
de una base fuerte de concentración
conocida.
se determinan por titulación.
Ejemplo se titula una solución de ácido
acético agregando pequeñas alícuotas
de una base fuerte de concentración
conocida.
Se mide el pH de la solución y se
gráfica en función de la cantidad de
equivalentes molares de base fuerte
agregados durante la titulación.
LOS AMINOÁCIDOS
Estructura de los Aminoácidos
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos
para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos
comunes, estándar o normales.
Los aminoácidos se llaman así porque son derivados aminados de ácidos carbonos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido.
[El nombre químico correcto, o nombre sistemático, se apega a reglas establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC, de International Union of Pure and Applied Chemistry) y la Unión Internacional de Bioquímica y Biología Molecular (IUBMB, de International Union of Biochemistry and Molecular Biology))
En 19 de los 20 aminoácidos que se usan en la biosíntesis de proteínas, el átomo de carbono a es quiral, o asimétrico, porque tiene cuatro grupos diferentes unidos a él. La excepción es la glicina, cuyo grupo R sólo es un átomo de hidrógeno (la molécula no es quiral, porque el átomo de carbono a está unida a dos átomos idénticos de hidrógeno). Los 19 aminoácidos quirales pueden, en consecuencia, existir como estereoisómeros. Los estereoisómeros son compuestos que tienen la misma fórmula molecular pero difieren en el orden o configuración de sus átomos en el espacio.
Por convención, los pares de imágenes especulares de aminoácidos se indican como:
Las estructuras de los 20 aminoácidos que suelen encontrarse en las proteínas como proyecciones de Fischer. Las propiedades de las cadenas laterales tienen gran influencia sobre la forma tridimensional
general, o conformación, de una proteína.
En las figuras se usan las abreviaturas de tres y de una letra para indicar cada aminoácido. La abreviatura de tres letras es evidente (en inglés), pero la abreviatura simple de una letra es menos obvia. Varios aminoácidos comienzan con la misma letra, de modo que se deben usar otras letras del alfabeto para tener una designación adecuada; por ejemplo, treonina T, tirosina Y y triptófano W. Estos identificadores se deben memorizar. Es importante aprenderse las estructuras de los aminoácidos estándar porque se enzimas y síntesis de proteínas.
Las cadenas laterales pertenecen a las siguientes clases químicas: alifática, aromática, sulfurada, alcohol, base, ácido y amida. De los 20 aminoácidos, cinco se subdividen en
muy (o altamente) hidrofóbicos (en gris claro) y siete se clasifican como muy hidrofílicos (en negro). Comprender la clasificación de los grupos R simplificará la memorización de las estructuras y los nombres.
Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral.
Grupos R aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromático Los tres aminoácidos aromáticos absorben luz ultravioleta (UV) porque, a diferencia de los aminoácidos alifáticos:
. Grupos R sulfurados
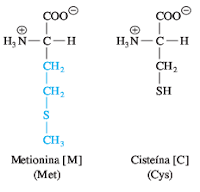
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos
.
Cadenas laterales con grupos alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas.
Grupos R básicos
Grupos R ácidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7.
Hidrofobicidad de las cadenas laterales de aminoácidos
Las diversas cadenas laterales en los aminoácidos van desde muy hidrofóbicas hasta muy hidrofílicas pasando por débilmente polares. La hidrofobicidad o hidrofilicidad (o hidrofilia) relativas de cada aminoácido se llama hidropatía.
Otros aminoácidos y derivados de aminoácidos
 En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies.
En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies.
Ionización de los aminoácidos
Las propiedades físicas de los aminoácidos reciben influencias de los estados iónicos de los grupos a-carboxilo y a-amino y de todos los grupos ionizables que haya en las cadenas laterales. Cada grupo ionizable guarda relación con un valor específico de pKa que corresponde al pH al que son iguales las concentraciones de las formas protonada y no protonada. Cuando el pH de la solución es menor que el pKa. predomina la forma protonada y el aminoácido es entonces un ácido real, capaz de donar un
protón. El pKa de un grupo ionizable corresponde a un punto medio en su curva de titulación.
Unión de aminoácidos por enlaces peptídicos en las proteínas
La secuencia lineal de aminoácidos en una cadena polipeptídica se llama estructura primaria de una proteína. A los niveles más altos de estructura se les llaman estructura secundaria, terciaria y cuaternaria. El enlace que se forma entre los aminoácidos es un enlace de amida y se llama enlace peptídico, o enlace de péptido.
Técnicas de purificación de las proteínas
Entre las técnicas tenemos:
- Cromatografía de intercambio iónico
- Cromatografía por filtración en gel
- La cromatografía de afinidad
Técnicas analíticas
- Electroforesis en gel de poliacrilamida
- La espectrometría de masas
- Espectrometría de masas por Eectroaspersión
LAS PROTEÍNAS
 Una conformación es un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes.
Una conformación es un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes.
Una proteína puede ser una sola cadena polipeptídica o puede estar formada por
varias de esas cadenas unidas entre sí por interacciones débiles.
El estudio de grandes conjuntos de proteínas, como el de todo el complemento de proteínas producidas por una célula, es parte de un campo emergente llamado proteómica.
Las proteínas tienen diversas formas. Muchas son macromoléculas aproximadamente esféricas, hidrosolubles y compactas cuyas cadenas polipeptídicas están dobladas de manera apretada. Esas proteínas globulares tienen un interior hidrofóbico y una superficie hidrofílica.
También los polipéptidos pueden ser partes de grandes estructuras subcelulares o extracelulares, como ribosomas, flagelos y cilios, músculos y cromatina. Las proteínas fibrosas son una clase particular de proteínas estructurales que proporcionan soporte mecánico a las células u organismo.
Hay cuatro niveles de estructura de las proteínas
La estructura secundaria se refiere a las regularidades en las conformaciones locales mantenidas por puentes de hidrógeno entre los hidrógenos de amida y los oxígenos de carbonilo en la columna vertebral del péptido. Las estructuras secundarias principales son las hélices a y las hebras b (incluyendo las láminas a). Las moléculas individuales de proteína se pueden describir mediante hasta cuatro niveles de estructura , la estructura primaria describe la secuencia lineal de residuos de aminoácidos en una proteína, La estructura tridimensional de una proteína se describe con tres niveles adicionales: estructura secundaria, estructura terciaria y estructura cuaternaria.
Métodos para determinar la estructura de las proteínas
Como la degradación de Edman, o en forma indirecta, a partir de la secuencia del gen. La técnica acostumbrada para determinar la conformación tridimensional de una proteína es la cristalografía con rayos X. En esta técnica se apunta un haz de rayos X colimados, o paralelos, a un cristal de moléculas de proteína. Los electrones en el cristal difractan los rayos X, que se registran entonces en una película, o mediante un detector electrónico.
El análisis matemático de la figura de difracción produce una imagen.

Conformación del grupo peptídico
Debido a la naturaleza del doble enlace en el enlace peptídico, la conformación del grupo peptídico se restringe a una de dos conformaciones posibles, que puede ser trans o cis. En la conformación trans, los dos carbonos a de residuos adyacentes de aminoácido están en lados opuestos del enlace peptídico y en las esquinas opuestas del rectángulo que forma el grupo peptídico plano. En la conformación cis, los dos carbonos a están en el mismo lado del enlace peptídico y están más cerca entre sí.
La conformación cis es menos favorable que la conformación trans, que
En consecuencia, casi todos los grupos peptídicos en las proteínas tienen la conformación trans.
Hebras b y láminas b
La otra estructura secundaria común se llama estructura b, una clase que incluye a hebras b y láminas b. Las hebras B son partes de la cadena polipeptídica que se encuentran casi totalmente extendidas. Cada residuo en una hebra b ocupa de 0.32 a 0.34 nm de la longitud total, en contraste con la espiral compacta de una hélice a, donde cada residuo corresponde a 0.15 nm de la longitud general. Cuando se ordenan varias hebras b lado a lado forman láminas B, estructura que propusieron originalmente Pauling y Corey cuando desarrollaban el modelo teórico de la hélice
Estructuras secundarias
Las estructuras secundarias, o motivos, son combinaciones reconocibles de hélices a, hebras b y giros que aparecen en diversas proteínas. A veces los motivos se relacionan con determinada función, aunque los motivos de estructura similar pueden tener funciones distintas en proteínas diferentes.
Dominios
Hay muchas proteínas que están formadas por varias unidades compactas, discretas, plegadas en forma independiente llamadas dominios. Los dominios pueden consistir en combinaciones de motivos. El tamaño de un dominio varía desde unos 25 a 30 residuos de aminoácidos hasta más de 300.
En la célula se sintetizan nuevos polipéptidos por un complejo de traducción que incluye ribosomas, ARNm y varios factores mas.
El efecto hidrofóbico
Las proteínas son más estables en agua cuando sus cadenas laterales hidrofóbicas se agrupan en el interior de la proteína y no quedan expuestas al medio acuoso en la superficie. Como las moléculas de agua interaccionan con más fuerza entre sí que con las cadenas laterales no polares de una proteína, estas cadenas son impulsadas a vincularse entre sí, lo cual determina que la cadena polipeptídica se colapse y forme un glóbulo fundido más compacto.
Puentes de hidrógeno
Los puentes de hidrógeno contribuyen a la cooperatividad del plegamiento y ayudan a estabilizar las conformaciones nativas de las proteínas. Los primeros puentes de hidrógeno son los que se forman en las hélices a, las láminas b y los giros, y forman regiones definidas de la estructura secundaria.
La colágena, una proteína fibrosa
Las proteínas seleccionadas para estudiar con más detalle son la colágena,
una proteína estructural, la mioglobina y la hemoglobina, proteínas que unen oxígeno y los anticuerpos. La colágena es la principal proteína componente del tejido conectivo de los vertebrados; constituye de 25 a 35% de las proteínas totales en los mamíferos. Las moléculas de colágena tienen formas y funciones notablemente distintas.
Estructuras de la mioglobina y la hemoglobina
Como la mayor parte de las proteínas, la mioglobina (Mb) y la hemoglobina (Hb), una proteína relacionada, desempeñan sus funciones biológicas al unirse en forma selectiva y reversible a otras moléculas —en este caso, al oxígeno molecular (O2).
El interior de la mioglobina está formado en forma casi exclusiva por residuos hidrofóbicos de aminoácidos, en especial los que son muy hidrofóbicos como valina, leucina, isoleucina, fenilalanina y metionina. La superficie de la proteína contiene residuos tanto hidrofílicos como hidrofóbicos.
Los anticuerpos se unen a antígenos específicos
Los vertebrados poseen un sistema inmunitario complicado que elimina sustancias extrañas como bacterias y virus infecciosos. Como parte de este sistema de defensa, los vertebrados sintetizan las proteínas llamadas anticuerpos (llamadas también inmunoglobulinas), que reconocen y se unen en forma específica con antígenos). Los anticuerpos son proteínas de multidominio que se unen con sustancias extrañas o antígenos marcándolas para su destrucción. Los dominios variables en los extremos de las cadenas pesadas y ligeras interactúan con el antígeno.
ENZIMAS
La vida es inconcebible sin las enzimas. Las enzimas son catalizadores enormemente potentes que exhiben una especificidad elevada. Sin catalizadores estas reacciones no serian suficientemente rápidas para mantener la vida.
En los seres vivos la temperatura elevada puede dañar las delicadas estructuras biológicas y las concentraciones de los reactantes son habitualmente bajas. Los seres vivos evitan estos problemas utilizando las enzimas. Las enzimas poseen varias propiedades notables. Como por ejemplo:
- Las velocidades de las reacciones que catalizan las enzimas suelen extraordinariamente elevadas.
- Las enzimas son muy específicas para las reacciones que catalizan.
- Poseen estructuras muy complejas, por lo tanto se puede regular.
Propiedades
Un catalizador es una sustancia que aumenta la velocidad de la reacción química y que no se altera de forma permanente por la reaccion. Los catalizadores realizan esta hazaña debido a que disminuyen la energía de activación que se requiere para una reaccion química. En otras palabras, los catalizadores proporcionan una ruta de reaccion alternativa que requiere menos energía.
La energía libre de activación se define como la cantidad de energía que se requiere para convertir 1 mol de moléculas de sustrato (reactante) desde el estado basal (la forma estable de baja energía de la molécula) al estado de transición.
La diferencia entre los catalizadores inorgánicos y las enzimas esta relaciona directamente con sus estructuras. A diferencia de los catalizadores inorgánicos, cada clase de moléculas enzimáticas contiene una superficie de unión de forma enrevesada y única denominada lugar activo. Los sustratos se unen en el lugar activo de la enzima que normalmente es una pequeña hendidura o grieta en una molécula proteica grande.
Las cadenas laterales de los aminoácidos que se encuentran en el lugar activo participan activamente en el proceso catalítico.
Otros factores, como los efectos electrostáticos, la catálisis acido base general y la catálisis covalente contribuyen a incrementar las velocidades de las reacciones catalizadas por las enzimas sobre las reacciones que no están catalizadas por enzimas.
El modelo llave-cerradura de la acción enzimática, expuesto por Emil Fisher en 1980, explica en parte la especificidad enzimática.
Los cofactores enzimáticos pueden ser iones, como el Mg o el Zn y también moléculas orgánicas complejas, denominadas coenzimas. El componente proteico de una enzima que carece de un cofactor esencial se denomina apoenzima. Las enzimas intactas con sus cofactores unidos se denominan holoenzima.
Clasificación de las enzimas
Las enzimas se clasifican según el capricho de sus descubridores. Las enzimas solían nombrarse añadiendo el sufijo –asa al nombre del sustrato. Por ejemplo, la ureasa cataliza la hidrólisis de la urea. Para eliminar la confusión, la unión internacional de Bioquímica (UIB) instituyo un esquema de denominación sistemático para las enzimas. Cada enzima se clasifica en la actualidad de acuerdo con la clase de reaccion que cataliza.
Las seis categorías principales de enzimas son:
----Oxidorreductasas: catalizan reacciones de oxidación-reducción
Ejemplos: deshidrogenasas, oxidasas, reductasas, peroxidasas.
-----Transferasas: catalizan reacciones en las que hay una transferencia de grupos de una molécula a otra.
Ejemplos: amino, carboxilo, carbonilo, metilo, fosforilo, etc.
Los nombres comunes suelen incluir prefijo trans. Ejemplo: transcarboxilasas, transaminasas.
----Hidrolasas: catalizan reacciones en la que se produce la rotura de enlaces por la adicción de agua. Ejemplo: esterasas, fosfatasas, etc.
----Liasas: catalizan reacciones en las que se eliminan grupos. Por ejemplo: H20, C02, NH3. Ejemplo: Liasas, descarboxilasas, hidratasas, etc.
---Isomerasas: catalizan varios tipos de reordenamiento intramoleculares. Ejemplo: epimerasas, mutasas.
----Ligasas: catalizan la formación de un enlace entre dos moléculas de sustrato. Ejemplo: piruvato Carboxilasa.
Cinética enzimática:
Es el estudio cuantitativo de la catálisis enzimática.
La velocidad de la reacción bioquímica se define como el cambio de la concentración de un reactante o producto por unidad de tiempo. La velocidad inicial Vo de la reaccion AàP
Otro término que es útil para describir una reaccion es el orden de la reaccion. El orden se determina de forma empírica, es decir mediante experimentación.
Cinética de Michaelis-Menten
Unos de los métodos más útiles en la investigación sistemática de las velocidades enzimática fueron propuestos por Leonor Michaelis y Maud Menten en 1913. El complejo enzima sustrato. Cuando se une el sustrato S en el lugar activo de una enzima E, se forma un complejo intermediario (ES) durante el estado de transición, el sustrato se convierte en producto.
La ecuación de Michaelis-Menten nos da una hipérbola.
Donde
K1= constante de la velocidad de la formación de ES
K2= constante de velocidad de la disociación de ES
K3= constante de velocidad de la formación y liberación del producto del lugar activo.
Representación de Lineweave-Burk
Se representa las inversas de las velocidades iniciales frente a las inversas de las concentraciones de sustrato. En estos gráficos, que se denominan representaciones dobles inversas de Line weaver-Burk.
Inhibición enzimática:
Las moléculas que reducen la actividad de una enzima, denominadas inhibidores, incluyen muchos fármacos, antibióticos, conservantes alimentarios y venenos.
En primer lugar y la razón más importante, en los seres vivos la inhibición enzimática es un medio importante para regular las rutas metabólicas.
En segundo lugar, numerosos tratamientos clínicos se fundamentan en la inhibición enzimática. Por ejemplos: muchos antibióticos y fármacos reducen o eliminar la actividad de enzimas específicas.
La inhibición enzimática puede producirse cuando un compuesto compite con el sustrato por el lugar activo de la enzima libre, se une al complejo ES en un lugar separado por el lugar activo, o se une a la enzima libre en un lugar separado del lugar activo. Se describe tres clases de inhibidores enzimáticos reversibles: se unen por enlace no covalente:
Inhibidores competitivos:
Se unen de forma reversible a la enzima libre, y no al complejo ES, para formar un complejo enzima-inhibidor (EI). La actividad de la enzima disminuye debido a que no se produce una reaccion productiva durante el tiempo limitado que existe el complejo EI. Con esta inhibición la Vmax permanece constante y el Km aumenta.
Inhibidores acompetitivos:
El inhibidor se une al complejo enzima-sustrato, y no a la enzima libre. La inhibición acompetitiva suele observarse en las reacciones en las que las enzimas unen más de un sustrato. Con la inhibición competitiva aumenta Km de la enzima y mantiene la Vmax inalterada.
Inhibidor no competitivo:
En algunas reacciones catalizadas por enzimas el inhibidor puede unirse tanto a la enzima como al complejo enzima-sustrato. Con la inhibición no competitiva el Vmax desciende y el Km permanece constante.
Existen dos formas de inhibición no competitiva: pura y mixta. La inhibición pura es un fenómeno poco frecuente ambos valores de K1 son equivalentes. La inhibición mixta es de forma característica más complicada debido a que los valores de K1 son diferentes.
Inhibición irreversible: el inhibidor normalmente se une en por enlace covalente a la enzima, con frecuencia a una cadena lateral del lugar activo.
Enzimas alostéricas: las mayorías de las enzimas alosterica son proteínas con varias subunidades. La actividad de las enzimas alosterica se ve afectada por moléculas efectoras que se unen a otros lugares denominados lugares alóstericos o reguladores.
Catálisis:
Se utiliza la cristalografía de rayos X.
Mecanismos catalíticos:
Varios factores contribuyen a la catálisis enzimática, los más importantes son: los efectos de proximidad y tensión, los efectos electrostáticos, la catálisis acido básica y la catálisis covalente.
Efectos de proximidad y tensión: cuando una enzima y el sustrato están muy próximos se comparten como si fueran parte de la misma molécula.
Efectos electrostáticos: está relacionado con la capacidad de las moléculas de disolverse de los alrededores para reducir las fuerzas de atracción entre los grupos químicos.
Catálisis ácidobásica: los grupos químicos pueden hacerse más reactivos añadiendo o eliminando un protón. El anillo imidazol protonado puede servir como acido general y el anillo imidazol desprotonado servir como base general.
Catálisis covalente: un grupo nucleófilo de una cadena lateral forma un enlace covalente inestable con el sustrato. El complejo enzima-sustrato forma el producto.
Función de los cofactores en la catálisis enzimática: las enzimas requieren cofactores no proteicos, es decir, cationes metálicos y coenzimas.
Metales: proporcionan una concentración elevadas de cargas positivas que es especialmente útil para la unión de las moléculas pequeñas. Debido a que los metales de transición actúan como acido de Lewis, son eficaces electrófilos.
Coenzimas: la mayoría derivan de las vitaminas.
Se dividen en: hidrosolubles y liposolubles.
Efectos de la temperatura y del pH sobre las reacciones catalizadas por las enzimas.
Las enzimas son especialmente sensibles a las variaciones de la temperatura y del pH
TEMPERATURA:
Cuanto mayor es la temperatura mayor es la velocidad de reaccion. Cada enzima tiene una temperatura óptima a la cual actúa con su máxima eficacia. Debido a que las enzimas son proteínas, los valores de temperatura óptima dependen del pH y de la fuerza iónica.
Si la temperatura se incrementa mas allá de la temperatura optima, la actividad enzimática disminuirá bruscamente. La temperatura optima de una enzima normalmente esta cerca de la temperatura normal del organismo del que procede. Por ejemplo: la temperatura óptima de la mayoría de las enzimas del ser humano está próxima a los 37° C
pH: la actividad catalítica está relacionada con el estado iónico del lugar activo. Si el pH es lo suficientemente alcalino para que el grupo pierda su protón. La actividad enzimática puede deprimirse.
Se
Medicamentos con contenido enzimático
Pancrelipase:
¿Para cuales condiciones o enfermedades se prescribe este medicamento?
Las capsulas de liberación retardada de pancrelipase ( Creon, Pancreaze, Pertsye . se utilizan ertzye, senpep) se utilizan para mejorar la digestión de alimentos en niños y adultos que no tienen suficientes enzimas pancreaticas. (sustancias necesarias para disolver los alimentos de tal forma que pueden ser digeridos) se utililizan) pertzye, senpep) se utlizan para mejorar la digestion de alimentos en niños y adultos que no tienen suficientes enzimas pancreaticas. (sustancias necesarias para disolver los alimentos de tal forma que pueden ser digeridos)
Pancrelipase se encuentra en un tipo de medicamentos llamado enzimas. pancrelipase actúa en lugar de las enzimas que normalmente producen páncreas. trabaja para disminuir las evacuaciones intestinales,grasas y mejorar la nutrición al disolver las grasas, proteínas y almidones de los alimentos en pequeñas sustancias que pueden absorberse del intestino.
¿como se debe usar este medicamento?
Se presenta en comprimidos y capsulas de liberación retardad de uso oral. se toma mucha agua con
cada comida refrigerio, por lo general de 5 a 6 veces al día. Pancrelipase se vende bajo diferentes nombre comerciales.
¿cuales son los efectos secundarios que podría este medicamento?
1- dolor de cabeza
2- tos
3- dolor de garganta.
4- dolor de cuello
5- acidez
6-gases, etc.
Marcas comerciales
· Creon®
· Pancreaze®
· Pertzye®
· Ultresa®
· Viokace®
· Zenpep
Coloplex
Forma: CAPSULAS
ATC: MEDICAMENTOS DIGESTIVOS CONTENIENDO ENZIMAS
Via: ORAL
Venta: BAJO RECETA
Principios Activos:
ESENCIA DE MENTA B.P. 0.2 ML
INDICACIONES
Las cápsulas no deben ser partidas ni masticadas. Una cápsula 3 veces por día, preferiblemente antes de las comidas e ingerida con una pequeña cantidad de agua. Las cápsulas no deben ser tomadas inmediatamente después del alimento. El tratamiento debe mantenerse hasta que los síntomas desaparezcan. La dosis puede elevarse a 2 cápsulas, 3 veces por día cuando son más severos los trastornos.
VITAMINAS
Las apoenzimas (sólo proteínas) inactivas requieren de los cofactores para convertirse en
holoenzimas activas. Hay dos tipos de cofactores: los iones esenciales (principalmente
iones metálicos) y los compuestos orgánicos llamados coenzimas.
Muchas enzimas requieren cationes inorgánicos
Estas enzimas se pueden dividir en dos grupos: enzimas activadas por metal y metaloenzimas. Las enzimas activadas por metal tienen necesidad absoluta de iones metálicos adicionales, o son estimuladas por adición de iones metálicos.
Las metaloenzimas contienen iones metálicos firmemente unidos en sus sitios activos. Los iones que más se suelen encontrar en las metaloenzimas son de metales de transición como hierro y zinc, y con menos frecuencia cobre y cobalto.
Los iones metálicos que se unen fuertemente a las enzimas con frecuencia tienen funciones predominantes en la catálisis. Los iones de algunas metaloenzimas pueden funcionar como catalizadores electrofílicos.
Los iones de otras metaloenzimas pueden tener reacciones reversibles de oxidación y
reducción, al transferir electrones de un sustrato reducido a un sustrato oxidado. Por ejemplo, el hierro es parte del grupo hemo de la catalasa, enzima que cataliza la degradación.
Clasificación de las coenzimas
Se puede clasificar a las coenzimas en dos tipos, según la forma en que interactúan con la; apoenzima Las coenzimas de un tipo, llamadas cosustratos, con frecuencia en realidad son sustratos en reacciones catalizadas por enzimas. El segundo tipo de coenzima se llama grupo prostético. Un grupo prostético permanece unido a la enzima durante la reacción.
La mayor parte de esas especies son capaces de sintetizar sus coenzimas a partir de precursores simples. Esto es válido en especial en cuatro de los cinco reinos: procariotas, protistas, hongos y planta.
Los mamíferos (incluyendo los humanos) necesitan una fuente de coenzimas, o de sus precursores inmediatos, para sobrevivir. Son suministradas por los nutrientes, por lo regular en pequeñas cantidades (microgramos
o miligramos por día). Estos compuestos esenciales se llaman vitaminas.
Las fuentes originales de vitaminas suelen ser plantas y microorganismos, aunque los animales carnívoros pueden obtener vitaminas de la carne
Puede sobrevenir una enfermedad por deficiencia nutricional cuando una vitamina es deficiente o está ausente en la dieta de un animal.
La palabra vitamina fue acuñada por Casimir Funk en 1912 para describir una "amina vital" de los hollejos del arroz, que curaba el beriberi, una enfermedad por deficiencia
nutricional que causa degeneración neural
La sustancia anti-beriberi (tiamina) se conoció como vitamina Desde entonces se han identificado dos amplias clases de vitaminas: las hidrosolubles (como las vitaminas B) y las liposolubles (llamadas también vitaminas lípidas). Aunque se demostró que muchas vitaminas son todo menos que amina
Las vitaminas hidrosolubles (solubles en agua) se requieren diariamente en pequeñas cantidades, porque son excretadas con facilidad en la orina y los almacenamientos celulares de sus coenzimas son inestables. Al revés, las vitaminas lípidas (solubles en grasas y aceites) como las vitaminas A, D, E y K, son almacenadas por los animales, y su ingestión exagerada puede causar estados de toxicidad llamados hipervitaminosis.
ATP y otros cosustratos nucleótidos.
el más abundante es el trifosfato de adenosina (ATP, adenosine triphosphate)
Entre otros ejemplos frecuentes están el GTP, la S-adenosilmetionina y azúcares nucleótido.
El ATP es un reactivo versátil que puede donar sus grupos fosforilo, pirofosforilo, adenililo (AMP) o adenosilo en reacciones de transferencia de grupo.
La reacción más común donde interviene el ATP es la transferencia del grupofosforilo
El ATP tiene una función central en el metabolismo.
El ATP también es la fuente de otras coenzimas metabólicas. Una es la S-adenosilmetionina y es sintetizada por la reacción de metionina con ATP.
NAD+ Y EL NADH
El ácido nicotínico (llamado también niacina) es el factorque falta en la pelagra. Es esencial como precursor de NAD y NADP. Las coenzimas de nicotinamida participan en muchas reacciones de oxidación-reducción. Ayudan en la transferencia de electrones hacia metabolitos y desde éstos. Las
formas oxidadas, NAD y NADP , carecen de electrones, y las formas reducidas,
Nótese que el signo “+” en el NAD
sólo indica que el átomo de nitrógeno tiene una carga positiva. Eso no quiere decir que toda la molécula tenga un ion con carga positiva; de hecho, tiene carga negativa debido a los fosfatos.
Casi siempre, el y el actúan como cosustratos para deshidrogenasas. Las deshidrogenasas dependientes de nucleótidos de piridina catalizan la oxidación de sus sustratos, transfiriendo dos electrones y un protón en forma de un ion hidruro (H-).
La mayor parte de las reacciones que forman NADH y NADPH son catabólicas. La oxidación de NADH en las mitocondrias está acoplada a la síntesis del ATP. La mayor parte del NADPH se usa como agente reductor en reacciones de biosíntesis.
La lactato deshidrogenasa es una oxidorreductasa que cataliza la oxidación reversible de lactato. La enzima es una deshidrogenasa típica dependiente de NAD. El lactato libera un protón cuando se reduce el NAD
AD y FMN
Las coenzimas flavina adenina dinucleótido (FAD) y flavina mononucleótido (FMN) se derivan de la riboflavina o vitamina B2
La riboflavina es sintetizada por bacterias, protistas, hongos, plantas y algunos animales. Los
amíferos obtienen riboflavina de su
mamiferos alimento. La riboflavina está formada por ribitol, un alcohol con cinco carbonos unido al átomo N-10 de un sistema de anillo heterocíclico llamado isoaloxazina.
La riboflavina es sintetizada por bacterias, protistas, hongos, plantas y algunos animales. Los
amíferos obtienen riboflavina de su
mamiferos alimento. La riboflavina está formada por ribitol, un alcohol con cinco carbonos unido al átomo N-10 de un sistema de anillo heterocíclico llamado isoaloxazina.
Muchas oxidorreductasas requieren FAD o FMN como grupo prostético. A esas enzimas se les llama flavoenzimas o flavoproteínas.
El FAD y FMN se reducen a FADH2 y FMNH2 omando un protón y dos electrones en forma de un ion hidruro.
Coenzima A
Esta coenzima interviene en reacciones de transferencia de grupo acilo, donde los grupos metabólicos móviles son ácidos carboxílicos y ácidos grasos simples.
Pirofosfato de tiamina
La tiamina (o vitamina B1) contiene un anillo de pirimidina y un anillo de tiazolio con carga positiva. En los mamíferos, la tiamina es una vitamina esencial. Abunda en las cáscaras de arroz y en otros cereales. Las deficiencias de vitamina B1 causan beriberi El TPP se sintetiza a partir de latiamina, por transferencia enzimática de un grupo pirofosforilo del ATP.
Fosfato de piridoxal:
La familia de vitaminas B6 hidrosolubles consiste en tres moléculas estrechamente relacionadas que sólo difieren en el estado de oxidación o aminación en el carbono unido a la posición 4 del anillo de piridina. La vitamina B6, con mayor frecuencia piridoxal o piridoxamina, se encuentra con facilidad en muchas fuentes vegetales y animales. Las deficiencias de B6 inducidas en ratas causan dermatitis y diversas alteraciones relacionadas con el metabolismo de las proteínas, pero en realidad son raras
las deficiencias de B6 en humanos.
Biotina
La biotina es un grupo prostético para enzimas que catalizan reacciones de transferencia del grupo carboxilo y reacciones de carboxilación dependientes de ATP. La biotina se identificó por primera vez como factor esencial para el crecimiento de las levaduras. Como la biotina es sintetizada por las bacterias intestinales, y sólo se requiere en muy pequeñas cantidades (microgramos por día), es rara la deficiencia de biotina en los humanos o animales alimentados con dietas normales. Sin embargo, se puedeinducir una deficiencia de biotina ingiriendo claras de huevo crudas, que contienen unaproteína l lamada avidina. La avidina se une fuertemente a la biotina y la hace no disponible para absorción en el tracto intestinal. Cuando se cocinan los huevos, la avidina se desnaturaliza y pierde su afinidad hacia la biotina.
Tetrahidrofolato:
La vitamina folato se aisló por primera vez a principios de la década de 1940, a partir de
hojas verdes, hígado y levadura. El folato tiene tres componentes principales: pterina (2-amino-4-oxopteridina), una mitad de ácido p-aminobenzoico, y un residuo de glutamato.
Los humanos requieren folato en su dieta, porque no pueden sintetizar el compuestopterina-ácido p-aminobenzoico (PABA, p-aminobenzoic acid), y no se puede adicionar glutamato a PABA exógeno.
La estructura de la coenzima folato, que se llaman tetrahidrofolato en forma colectiva, difieren de la vitamina en dos cosas: son compuestos reducidos.
Cobalamina: La cobalamina (vitamina B2) es la mayor de las vitaminas B, y fue la última que se aisló. La estructura de la cobalamina (tiene un sistema corrin anular que se asemeja al sistema anular de porfirina en el hemo).
Algunas especies de bacterias sintetizan la cobalamina. Todos los animales la requieren como micronutriente, y también algunas bacterias y algas. Las plantas no requieren cobalamina, por lo que no la sintetizan. En consecuencia, y en el caso normal, los humanos obtienen la vitamina B12
a partir de alimentos de origen animal. Con frecuencia, los vegetarianos logran cantidades adecuadas producidas por microorganismos. La deficiencia de cobalamina puede causar anemia perniciosa, enfermedad potencialmente fatal debida a una disminución en la producción de glóbulos rojos por la médula ósea. La anemia perniciosa también puede causar afecciones neurológicas.
La mala absorción de la cobalamina se combate hoy con inyecciones periódicas de la vitamina.
Lipoamida: La coenzima lipoamida es la forma de ácido lipoico unida a proteína. Aunque a menudo
se dice que el ácido lipoico es una vitamina B, parece que los animales pueden sintetizarlo. Lo requieren ciertas bacterias y protozoarios para crecer.
Vitaminas lipídicas
Las estructuras de las cuatro vitaminas lipídicas (A, D, E y K) contienen anillos y largascadenas laterales alifáticas. Las vitaminas lipídicas son muy hidrofóbicas, aunque cada una posee cuando menos un grupo polar. Al ingerirse son absorbidas en el intestino por un proceso parecido a la absorción de otros nutrientes lípidos. Después de digerir toda la proteína que pueda estar unida a ellas, son arrastradas a la interfase celular del intestino en forma de micelas formadas con sales biliares.
Vitamina A
La vitamina A, o retinol, es una molécula lipídica con 20 carbonos, que se obtiene en
la dieta, ya sea en forma directa o indirecta, como b-caroteno. Las zanahorias y otras
verduras amarillas son ricas en b-caroteno, un lípido vegetal con 40 carbonos cuya ruptura oxidante enzimática produce la vitamina A. La vitamina A existe en tres formas que difieren en estado de oxidación del grupo funcional terminal: el retinol, un alcohol estable, el retinal, un aldehído, y el ácido retinoico. El ácido retinoico es un compuesto señalador que se une a proteínas receptoras dentro de las células.
El aldehído retinal es un compuesto sensible a la luz, con importante papel en la visión
Vitamina D
La vitamina D es un nombre colectivo de un grupo de lípidos relacionados. Cuando los humanos se exponen a suficiente luz solar, se forma vitamina D3 (colecalciferol) en forma no enzimática, en la piel, a partir del esteroide 7-dehidrocolesterol. La vitamina D2 , compuesto relacionado con la vitamina D3 (la D2 tiene un grupo metilo adicional) es el aditivo en leches fortificadas. La forma activa de la vitamina D3, el 1,25-dihidroxicolecalciferol, se forma a partir de la vitamina D3 mediante dos reacciones de hidroxilación.
la vitamina D regula tanto la absorción intestinal del calcio, como su depósito en los huesos. En enfermedades por deficiencia de vitamina D, como raquitismo en niños y osteomalacia en adultos, los huesos son débiles, porque el fosfato de calcio no cristaliza bien sobre la matriz de colágeno en los huesos.
Vitamina E
La vitamina E, o a-tocoferol es uno de varios tocoferoles estrechamente relacionados; son compuestos que tienen un sistema anular bicíclico oxigenado, con una cadena lateral hidrofóbica
Se cree que la vitamina E funciona como agente reductor que secuestra oxígeno y radicales libres.
Son raras las deficiencias de vitamina E, pero pueden causar glóbulos rojos frágiles y daño eurológico.
Ubiquinona:
coenzima soluble en lípidos, sintetizada por casi todas las especies. Es una benzoquinona con cuatro sustituyentes, uno de los cuales es una larga cadena hidrofóbica. Algunas bacterias usan menaquinona en vez de ubiquinona.
Proteínas coenzimas:Algunas proteínas funcionan como coenzimas. No catalizan reacciones ellas mismas, pero ciertas enzimas las necesitan. Esas coenzimas se llaman proteínas de transferencia
de grupo, o proteínas coenzimas. Contienen un grupo funcional que es parte de la columna vertebral de la proteína, o bien es un grupo prostético. En general son más pequeñas y más termoestables que la mayor parte de las enzimas. Las proteínas coenzimas se llaman coenzimas porque participan en muchas y diversas reacciones, y se asocian a una variedad de enzimas diferentes.
Citocromos:
Los citocromos son proteínas coenzimas que contienen hemo, cuyos átomos de Fe(III)
sufren reducción reversible de un electrón. Los citocromos pueden ser de clase a, b y c, de acuerdo con sus espectros de absorción visibe.
VITAMINA B6
• Nombre genérico y comercial
• Genérico: piridoxina o vitamina B6.
• Comercial: BenadonRroche
VITAMINA B12
• Nombre genérico y comercial
• Genérico; Vitamina B12 o cobalaminas (hidroxocobalamina, cianocobalamina).
• Comercial; Dalamon, Vitafardi-C-B12, Neurodavur, Neurodavur Plus, Reticulogen fortificado, Optovite B12 1000 gammas, Nervobion, Hidroxil.
El FAD y FMN se reducen a FADH2 y FMNH2 omando un protón y dos electrones en forma de un ion hidruro.
Esta coenzima interviene en reacciones de transferencia de grupo acilo, donde los grupos metabólicos móviles son ácidos carboxílicos y ácidos grasos simples.
Pirofosfato de tiamina
La tiamina (o vitamina B1) contiene un anillo de pirimidina y un anillo de tiazolio con carga positiva. En los mamíferos, la tiamina es una vitamina esencial. Abunda en las cáscaras de arroz y en otros cereales. Las deficiencias de vitamina B1 causan beriberi El TPP se sintetiza a partir de latiamina, por transferencia enzimática de un grupo pirofosforilo del ATP.
Fosfato de piridoxal:
La familia de vitaminas B6 hidrosolubles consiste en tres moléculas estrechamente relacionadas que sólo difieren en el estado de oxidación o aminación en el carbono unido a la posición 4 del anillo de piridina. La vitamina B6, con mayor frecuencia piridoxal o piridoxamina, se encuentra con facilidad en muchas fuentes vegetales y animales. Las deficiencias de B6 inducidas en ratas causan dermatitis y diversas alteraciones relacionadas con el metabolismo de las proteínas, pero en realidad son raras
las deficiencias de B6 en humanos.
Biotina
La biotina es un grupo prostético para enzimas que catalizan reacciones de transferencia del grupo carboxilo y reacciones de carboxilación dependientes de ATP. La biotina se identificó por primera vez como factor esencial para el crecimiento de las levaduras. Como la biotina es sintetizada por las bacterias intestinales, y sólo se requiere en muy pequeñas cantidades (microgramos por día), es rara la deficiencia de biotina en los humanos o animales alimentados con dietas normales. Sin embargo, se puedeinducir una deficiencia de biotina ingiriendo claras de huevo crudas, que contienen unaproteína l lamada avidina. La avidina se une fuertemente a la biotina y la hace no disponible para absorción en el tracto intestinal. Cuando se cocinan los huevos, la avidina se desnaturaliza y pierde su afinidad hacia la biotina.
Tetrahidrofolato:
La vitamina folato se aisló por primera vez a principios de la década de 1940, a partir de
hojas verdes, hígado y levadura. El folato tiene tres componentes principales: pterina (2-amino-4-oxopteridina), una mitad de ácido p-aminobenzoico, y un residuo de glutamato.
Los humanos requieren folato en su dieta, porque no pueden sintetizar el compuestopterina-ácido p-aminobenzoico (PABA, p-aminobenzoic acid), y no se puede adicionar glutamato a PABA exógeno.
La estructura de la coenzima folato, que se llaman tetrahidrofolato en forma colectiva, difieren de la vitamina en dos cosas: son compuestos reducidos.
Cobalamina: La cobalamina (vitamina B2) es la mayor de las vitaminas B, y fue la última que se aisló. La estructura de la cobalamina (tiene un sistema corrin anular que se asemeja al sistema anular de porfirina en el hemo).
Algunas especies de bacterias sintetizan la cobalamina. Todos los animales la requieren como micronutriente, y también algunas bacterias y algas. Las plantas no requieren cobalamina, por lo que no la sintetizan. En consecuencia, y en el caso normal, los humanos obtienen la vitamina B12
a partir de alimentos de origen animal. Con frecuencia, los vegetarianos logran cantidades adecuadas producidas por microorganismos. La deficiencia de cobalamina puede causar anemia perniciosa, enfermedad potencialmente fatal debida a una disminución en la producción de glóbulos rojos por la médula ósea. La anemia perniciosa también puede causar afecciones neurológicas.
La mala absorción de la cobalamina se combate hoy con inyecciones periódicas de la vitamina.
Lipoamida: La coenzima lipoamida es la forma de ácido lipoico unida a proteína. Aunque a menudo
se dice que el ácido lipoico es una vitamina B, parece que los animales pueden sintetizarlo. Lo requieren ciertas bacterias y protozoarios para crecer.
Vitaminas lipídicas
Las estructuras de las cuatro vitaminas lipídicas (A, D, E y K) contienen anillos y largascadenas laterales alifáticas. Las vitaminas lipídicas son muy hidrofóbicas, aunque cada una posee cuando menos un grupo polar. Al ingerirse son absorbidas en el intestino por un proceso parecido a la absorción de otros nutrientes lípidos. Después de digerir toda la proteína que pueda estar unida a ellas, son arrastradas a la interfase celular del intestino en forma de micelas formadas con sales biliares.
Vitamina A
La vitamina A, o retinol, es una molécula lipídica con 20 carbonos, que se obtiene en
la dieta, ya sea en forma directa o indirecta, como b-caroteno. Las zanahorias y otras
verduras amarillas son ricas en b-caroteno, un lípido vegetal con 40 carbonos cuya ruptura oxidante enzimática produce la vitamina A. La vitamina A existe en tres formas que difieren en estado de oxidación del grupo funcional terminal: el retinol, un alcohol estable, el retinal, un aldehído, y el ácido retinoico. El ácido retinoico es un compuesto señalador que se une a proteínas receptoras dentro de las células.
El aldehído retinal es un compuesto sensible a la luz, con importante papel en la visión
Vitamina D
La vitamina D es un nombre colectivo de un grupo de lípidos relacionados. Cuando los humanos se exponen a suficiente luz solar, se forma vitamina D3 (colecalciferol) en forma no enzimática, en la piel, a partir del esteroide 7-dehidrocolesterol. La vitamina D2 , compuesto relacionado con la vitamina D3 (la D2 tiene un grupo metilo adicional) es el aditivo en leches fortificadas. La forma activa de la vitamina D3, el 1,25-dihidroxicolecalciferol, se forma a partir de la vitamina D3 mediante dos reacciones de hidroxilación.
la vitamina D regula tanto la absorción intestinal del calcio, como su depósito en los huesos. En enfermedades por deficiencia de vitamina D, como raquitismo en niños y osteomalacia en adultos, los huesos son débiles, porque el fosfato de calcio no cristaliza bien sobre la matriz de colágeno en los huesos.
Vitamina E
La vitamina E, o a-tocoferol es uno de varios tocoferoles estrechamente relacionados; son compuestos que tienen un sistema anular bicíclico oxigenado, con una cadena lateral hidrofóbica
Se cree que la vitamina E funciona como agente reductor que secuestra oxígeno y radicales libres.
Son raras las deficiencias de vitamina E, pero pueden causar glóbulos rojos frágiles y daño eurológico.
coenzima soluble en lípidos, sintetizada por casi todas las especies. Es una benzoquinona con cuatro sustituyentes, uno de los cuales es una larga cadena hidrofóbica. Algunas bacterias usan menaquinona en vez de ubiquinona.
Proteínas coenzimas:Algunas proteínas funcionan como coenzimas. No catalizan reacciones ellas mismas, pero ciertas enzimas las necesitan. Esas coenzimas se llaman proteínas de transferencia
de grupo, o proteínas coenzimas. Contienen un grupo funcional que es parte de la columna vertebral de la proteína, o bien es un grupo prostético. En general son más pequeñas y más termoestables que la mayor parte de las enzimas. Las proteínas coenzimas se llaman coenzimas porque participan en muchas y diversas reacciones, y se asocian a una variedad de enzimas diferentes.
Citocromos:
Los citocromos son proteínas coenzimas que contienen hemo, cuyos átomos de Fe(III)
sufren reducción reversible de un electrón. Los citocromos pueden ser de clase a, b y c, de acuerdo con sus espectros de absorción visibe.
Medicamentos que contienen vitaminas
VITAMINA B1
• Nombre generico y comercial
• Genérico: Tiamina
• Comercial: NeurodavurR
• Nombre generico y comercial
• Genérico: Tiamina
• Comercial: NeurodavurR
VITAMINA B6
• Nombre genérico y comercial
• Genérico: piridoxina o vitamina B6.
• Comercial: BenadonRroche
VITAMINA B12
• Nombre genérico y comercial
• Genérico; Vitamina B12 o cobalaminas (hidroxocobalamina, cianocobalamina).
• Comercial; Dalamon, Vitafardi-C-B12, Neurodavur, Neurodavur Plus, Reticulogen fortificado, Optovite B12 1000 gammas, Nervobion, Hidroxil.
HIDROXIL B1 - B6 - B12
• Existe un fármaco que contiene las tres vitaminas:
• Nombre comercial: BenexolRroche B1+B6+B12
• Existe un fármaco que contiene las tres vitaminas:
• Nombre comercial: BenexolRroche B1+B6+B12
CARBOHIDRATOS
 Los carbohidratos (también llamados sacáridos), con base en su masa, son la clase
Los carbohidratos (también llamados sacáridos), con base en su masa, son la clasemás abundante de moléculas biológicas en la Tierra. Aunque todos los organismos
pueden sintetizar carbohidratos, muchos de ellos se producen en organismos fotosintéticos, como bacterias, algas y plantas. Estos organismos convierten la energía solar en energía química, que a continuación se usa para fabricar carbohidratos a partir de
dióxido de carbono. Los carbohidratos tienen varios papeles fundamentales en los organismos vivos. En animales y plantas, los carbohidratos poliméricos funcionan como moléculas almacenadoras de energía. Los animales pueden ingerir carbohidratos, que a continuación se puedan oxidar para obtener energía para los procesos metabólicos. También se encuentran carbohidratos poliméricos en las paredes celulares y en los recubrimientos protectores de muchos organismos; otros carbohidratos polímeros son moléculas marcadoras que permiten que un tipo de célula reconozca e interaccione con otro tipo.
Se pueden describir los carbohidratos por la cantidad de unidades monómeras que contienen. Los monosacáridos son las unidades más pequeñas de estructura de carbohidratos. El nombre carbohidrato, “hidrato de carbono”, indica que su fórmula empírica es (CH2O)n en donde n es 3 o más (en general n es 5 o 6, pero puede ser hasta 9). Los oligosacáridos son polímeros con dos hasta unos 20 residuos de monosacárido. Los oligosacáridos más comunes son los disacáridos, formados por dos residuos de monosacárido unidos.
Los polisacáridos son polímeros que contienen muchos (en general más de 20) residuos de monosacáridoLa mayor parte de los compuestos quirales.
Los monosacáridos son sólidos blancos, cristalinos y solubles en agua que tienen sabor
dulce. Entre los ejemplos están la glucosa y la fructosa. Desde el punto de vista químico,
los monosacáridos son polihidroxi aldehídos o aldosas, o polihidroxi cetonas o cetosas.
Se clasifican por el tipo de grupo carbonilo y por la cantidad de átomos de carbono.
Como regla, se usa el sufijo -osa para dar nombre a los carbohidratos, aunque hay varias
excepciones. Todos los monosacáridos tienen al menos tres átomos de carbono. Uno de
ellos es el carbono carbonílico, y cada uno de los restantes tiene un grupo hidroxilo.
---- Los monosacáridos más pequeños son triosasazúcares con tres carbonos la triosa aldehídica, o aldotriosa, es el gliceraldehído.
----La triosa cetónicao cetotriosaes la dihidroxiacetona
La convención de designar a los isómeros como D y L se basó originalmente en las propiedades ópticas del gliceraldehído.
La forma del gliceraldehído que causaba la rotación hacia la derecha (dextrorrotatoria)
se designó como D; la que causaba la rotación hacia la izquierda (levorrotatoria) se designó como L.
Se puede considerar que las aldosas y las cetosas más largas son prolongaciones del gliceraldehído y la dihidroxiacetona, respectivamente, y que los grupos quirales.
Cuando las moléculas de azúcar tienen distinta configuración sólo en uno de varios centros quirales, se llaman epímeros. Por ejemplo, la D-manosa y la D-galactosa son epímeros de la D-glucosa.
Ciclación de aldosas y hexosas
El comportamiento óptico de algunos monosacáridos parece indicar que tienen un átomo de carbono más que lo que se ve en las estructuras.
La causa de esta asimetría adicional es una reacción de ciclación intramolecular, produce un nuevo centro quiral en el átomo de carbono del grupo carbonilo.
Como se parece al compuesto heterocíclico pirano, de seis miembros (figura 8.7a), al anillo con seis miembros de un monosacárido se le llama piranosa. Cómo el anillo con cinco miembros de un monosacárido se parece al del furano, se le llama furanosa.
El carbono más oxidado de un monosacárido ciclado, el que está unido a dos átomos de oxígeno, se llama carbono anomérico.
Derivados de los monosacáridos
Entre estos derivados están los monosacáridos polimerizados, como los oligosacáridos y los polisacáridos, igual que varias clases de compuestos no polimerizados. En esta sección se presentarán algunos derivados de monosacárido, incluyendo fosfatos de azúcar, desoxi y aminoazúcares, azúcares alcoholes, azúcares ácidos y el
ácido ascórbico (vitamina C).
Igual que otras biomoléculas formadoras de polímeros, los monosacáridos y sus
derivados tienen abreviaturas con las que se describen los polisacáridos más complejos.
Las abreviaturas aceptadas tienen tres letras, y en algunos casos.
Fosfatos de azúcar
Los monosacáridos, en las vías metabólicas, con frecuencia se convierten en ésteres de
fosfato
Desoxiazúcares:
En esos derivados, un átomo de hidrógeno sustituye a uno de los grupos hidroxilo del monosacárido
precursor. La 2-desoxi-D-ribosa es un bloque constructivo importante en el ADN. La
L-fucosa (6-desoxi-L-galactosa) está muy distribuida en plantas, animales y microorganismos.
Aminoazúcares
En varios azúcares, un grupo amino sustituye uno de los grupos hidroxilo del monosacárido precursor. A veces el grupo amino está acetilado
Azúcares alcoholes
En un azúcar alcohol el oxígeno carbonílico del monosacárido precursor se ha reducido
y se produce un polihidroxialcoholes.
Azúcares ácidos
Ácido ascórbico
Disacáridos y otros glicósidos
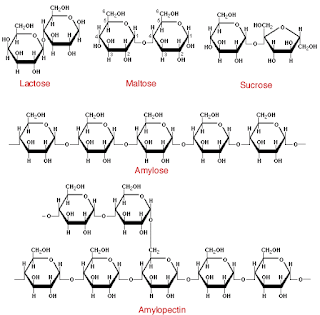
El enlace glicosídico es el principal enlace estructural en todos los polímeros de los monosacáridos. Es un enlace acetal, donde el carbono anomérico de un azúcar se condensa con un alcohol, una amina o un tiol. Por ejemplo, la glucopiranosa puede reaccionar con metanol en solución ácida, para formar un acetal (figura 8.19). Los compuestos que tienen enlaces glicosídicos se llaman glicósidos. Los glucósidos son una clase especial de glicósidos, donde la glucosa aporta el carbono anomérico. Entre los glicósidos hay disacáridos, polisacáridos y algunos derivados de carbohidrato.
Azúcares reductores y no reductores
Como los monosacáridos y la mayor parte de los disacáridos son hemiacetales y enconsecuencia contienen un grupo carbonilo reactivo, se oxidan con facilidad y forman productos diversos, propiedad que se usa con frecuencia para analizarlos. Esos carbohidratos, incluyendo glucosa, maltosa, celobiosa y lactosa, se llaman a veces azúcares reductores. Los azúcares reductores se detectaban por su capacidad de reducir iones
metálicos, como o Ag y formar productos insolubles. Los carbohidratos queson acetales, como la sacarosa, no se oxidan con facilidad, porque ambos átomos de carbono anoméricos están fijos en un enlace glicosídico. Se clasifican como azúcares no reductores.
La capacidad reductora de un azúcar polímero tiene interés más que analítico. Las
cadenas poliméricas de los oligosacáridos y polisacáridos tienen direccionalidad, conbase en sus extremos reductores y no reductor.
Polisacáridos
Los homoglicanos (u homopolisacáridos) son polímeros que sólo contienen residuos de un tipo de monosacárido. Los heteroglicanos (o heteropolisacáridos) son polímeros que contienenresiduos de más de un tipo de monosacárido.
Almidón y glucógeno
Todas las especies sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir energía metabólica.
Celulosa y quitina
La celulosa es un polisacárido estructural. Es uno de los principales componentes de las paredes celulares rígidas que rodean muchas células vegetales. Los tallos y las ramas de muchas plantas están formados principalmente por celulosa. Este solo polisacárido forma un porcentaje apreciable de toda la materia orgánica en la Tierra. Igual que la amilosa, la celulosa es un polímero lineal de residuos de glucosa, pero en la celulosa esos.
Glicoconjugados:
Los glicoconjugados consisten en polisacáridos unidos a (conjugados con) proteínas o péptidos. En muchos casos, los polisacáridos consisten en varias unidades distintas demonosacárido. Por consiguiente, son heteroglicanos. (Almidón, glucógeno, celulosa y quitina son homoglicanos). Los heteroglicanos aparecen en tres tipos de glicoconjugados: proteoglicanos, peptidoglicanos y glicoproteínas.
Proteoglicanos
Los proteoglicanos son complejos de proteínas y una clase de polisacáridos llamados glicosaminoglicanos. Esos glicoconjugados se presentan principalmente en la matriz extracelular (tejido conectivo) de animales multicelulares. Los glicosaminoglicanos son heteroglicanos no ramificados de unidades repetitiva.
Peptidoglicanos
Los peptidoglicanos son polisacáridos unidos a péptidos pequeños. Las paredes celulares
de muchas bacterias contienen una clase especial de peptidoglicano con un componente de heteroglicano unido a un péptido de cuatro o cinco residuos. El componente heteroglicano está formado por residuos alternados de GlcNAc y ácido N-acetilmurámico
(MurNAc
Glicoproteínas
Las glicoproteínas, como los proteoglicanos, son proteínas que contienen oligosacáridos unidos en forma covalente (es decir, proteínas que están glicosiladas; los proteoglicanos son un tipo de glicoproteína). Las cadenas de carbohidrato de una glicoproteína
varían de longitud, de 1 hasta más de 30 residuos, y pueden formar hasta 80% de la masa total de la molécula.
Medicamentos que contenga Hidratos de Carbono
FLEBOPLAST LEVULOSA GRIFOLS
FLEBOPLAST LEVULOSA GRIFOLS Sol. iny. 5% env. con 250 ml
Clase terapéutica: Sangre y derivados
Principios activos: Fructosa
ATC: Carbohidratos
Laboratorio: GRIFOLS
Fleboplast Glucosalina Grifols pertenece al grupo de soluciones intravenosas que afectan el balance
electrolítico.
Fleboplast Glucosalina Grifols está indicada en:
- Estados de deshidratación (pérdida de agua corporal) con pérdidas moderadas de electrolitos
- Alteraciones del metabolismo hidrocarbonado
- Estados de alcalosis leves
- Como vehículo para la administración de medicamentos y electrolitos.
POSIBLES EFECTOS ADVERSOS:
Al igual que todos los medicamentos, Fleboplast Glucosalina Grifols puede producir efectos adversos,
aunque no todas las personas los sufran.
Si la administración de la solución se realiza de forma correcta y controlada, las únicas complicaciones
posibles son las derivadas de la técnica de administración por vía intravenosa, que incluyen fiebre,
infección en la zona de inyección, dolor, reacción y/o irritación en la zona de inyección, trombosis
venosa o flebitis que se extiende desde el lugar de la inyección y extravasación.
Composición de Fleboplast Glucosalina Grifols:
Los principios activos son la glucosa y el cloruro de sodio. Cada 100 ml de solución contienen 3,3 g
de glucosa (como monohidrato) y 0,3 g de cloruro de sodio.
Los demás componentes son: ácido clorhídrico (para ajuste de pH) y agua para preparaciones
inyectables.
SUERO LEVULOSADO BIEFFE MEDITAL CLEAR FLEX
Sol. iny. 5% env. con 20 bolsas de 500 ml
| Clase terapéutica: | Sangre y derivados |
| Principios activos: | Fructosa |
| ATC: | Carbohidratos |
| Laboratorio: | BAXTER |
Sangre y órganos hematopoyéticos > Sustitutos de sangre y soluciones para perfusión > Soluciones IV > Soluciones para nutrición parenteral.
GLUCOSA IFE Sol. para perfusión 10 % env. con 10x1000 ml
| Clase terapéutica: | Sangre y derivados |
| Principios activos: | Glucosa monohidratada |
| ATC: | Carbohidratos |
| Laboratorio: | INSTITUTO FARMACOLOGICO ESPAÑOL |
| Enfermedades: Tratamientos |
Nutrición parenteral , Vehículo para administración de medicamentos y electrolitos , Alteraciones del metabolismo de hidratos de carbono , Deshidratación hipertónica
|
Los lípidos
 -Son componentes esenciales de todos los organismos vivos.
-Son componentes esenciales de todos los organismos vivos. - Los lípidos tienen gran solubilidad en solventes orgánicos no polares.
-Son hidrofóbicos (no polares) o bien son anfipáticos (contienen regiones polares y no polares al mismo tiempo).
-Los lípidos más simples son los ácidos grasos.
-Los ácidos grasos son componentes de muchos tipos de lípidos más complejos.
Diversidad estructural y funcional de los lípidos
Los lípidos que contienen grupos fosfato se llaman fosfolípidosLos que tienen grupos esfingosina y carbohidrato a la vez se llaman glicoesfingolípidos.
Los esteroides, las vitaminas lipídicas y los terpenos se relacionan con la molécula de isopreno, de cinco carbonos, y por consiguiente se llaman isoprenoides.
El nombre terpenos se ha aplicado a todos los isoprenoides, pero en general se restringe a los que existen en las plantas.
Los lípidos tienen funciones biológicas diversas, al igual que estructuras diversas.
Ácidos grasos
- En varias especies se han identificado más de 100 ácidos grasos distintos.
- Los ácidos grasos difieren entre sí en la longitud de sus colas de hidrocarburo.
- Las cantidad de dobles enlaces carbono-carbono, las posiciones de los dobles enlaces en las cadenas y la cantidad de ramificaciones.
- La mayor parte de los ácidos grasos tienen un pKa aproximado de 45 a 5.0.
- Están ionizados al pH fisiológico.
- Los ácidos grasos son una forma detergente, porque tienen una larga cola hidrofóbica y una cabeza polar.
- Como es de esperar, la concentración de ácido graso libre en las células es muy baja. porque altas concentraciones de ácidos grasos libres podrían romper las membranas.
- Los ácidos grasos que no contienen dobles enlaces carbono-carbono se llaman saturados.
- Los que tienen al menos un doble enlace carbono-carbono se clasifican como no saturados o insaturados.
- Los ácidos grasos no saturados que sólo tienen un doble enlace carbono-carbono se llaman monoinsaturados
- Los que tienen dos o más enlace carbono-carbono se denominan poliinsaturados.
- La configuración de los dobles enlaces en los ácidos grasos no saturados es cis, en general.
Una notación taquigráfica para identificar los ácidos grasos es usar dos números separados por dos puntos (:); el primero indica la cantidad de átomos de carbono en el ácido graso, y el segundo, la cantidad de dobles enlaces carbono-carbono, con sus posiciones indicadas como superíndices después de una letra griega Δ.
Por ejemplo: Algunos ácidos grasos se llaman omega-3 (por ejemplo 18:3 Δ9,12,15), omega-6 (por ejemplo, 18:2 Δ 9,12) u omega-9 (por ejemplo 18:1 Δ9).
Propiedades Físicas:
- Los ácidos grasos saturados son sólidos céreos a temperatura ambiente (22 °C).
- En tanto que los ácidos grasos no saturados son líquidos a esta temperatura.
- La longitud de la cadena de hidrocarburo en un ácido graso, y su grado de insaturación , influyen sobre el punto de fusión.
- En consecuencia, los ácidos grasos no saturados cis tienen menores puntos de fusión que los ácidos grasos saturados.
- Hay algunos, en la dieta humana, que tienen la configuración trans.
- Los ácidos grasos trans pueden originarse en fuentes animales, como productos lácteos y carnes de rumiantes. La mayor parte de los ácidos grasos trans comestibles están, sin embargo, en forma de aceites vegetales hidrogenados en algunas margarinas o mantecas. Los ácidos grasos monoinsaturados trans en la dieta pueden aumentar las concentraciones de colesterol en el plasma, así como de los triglicéridos, y por eso su ingestión puede aumentar el riesgo de enfermedades cardiovasculares.
de organismo, su órgano (en los organismos multicelulares) y su fuente alimenticia. Los
ácidos grasos más abundantes en los animales suelen ser oleato (18:1), palmitato (16:0)
y estearato (18:0).
Triacilgliceroles
- En general, los ácidos grasos se almacenan en forma de lípidos neutros llamados triacilgliceroles o triglicéridos.
- Están formados por tres residuos de acilo graso esterificados con glicerina, un azúcar alcohol de tres carbono.
- Son muy hidrofóbicos.
- Las grasas y los aceites son mezclas de triacilgliceroles.
- Pueden ser sólidos (grasas) o líquidos (aceites), dependiendo de sus composiciones de ácidos grasos y de la temperatura.
- Los triacilgliceroles que sólo contienen grupos acilo graso saturado y de cadena larga tienden a ser sólidos a la temperatura corporal, y los que contienen grupos acilo graso no saturados o de cadena corta, tienden a ser líquido.
- La mayor parte de los lípidos en la dieta humana promedio son triacilgliceroles.
- Esos lípidos se descomponen en el intestino delgado por acción de las lipasas. La lipasa pancreática cataliza la hidrólisis de los ésteres primarios (en el C-1 y C-3) de los triacilgliceroles liberando los ácidos grasos y generando monoacilgliceroles. Como los lípidos no son solubles en el agua, la digestión de los lípidos se lleva a cabo en presencia de detergentes enérgicos, llamados sales biliares.
- En la mayor parte de las células, los triacilgliceroles coalescen en forma de gotitas de grasa.
- En los mamíferos, la mayor parte de la grasa se almacena en el tejido adiposo, formado por células especializadas llamadas adipocitos. Cada adipocito contiene una gota grande de grasa que forma casi todo el volumen de la célula. Aunque están distribuidos en los organismos de los mamíferos, la mayor parte de los tejidos adiposos están justo bajo la piel y en la cavidad, abdominal. La abundante grasa subcutánea sirve como depósito de almacenamiento de energía y como aislador térmico. La grasa subcutánea es notable en especial en los mamíferos acuáticos.
Glicerofosfolípidos
-También se llaman fosfoglicéridos; como los triacilgliceroles tienen un soporte de glicerol.
-Los glicerofosfolípidos más sencillos, los fosfatidatos, consisten en dos grupos acilo graso esterificados en el C-1 y C-2 del 3-fosfato de glicerol.
-Los fosfatidatos están presentes en pequeñas cantidades como intermedios en la biosíntesis o descomposición de glicerofosfolípidos más complejos.
-Tienen ácidos grasos
saturados esterificados en el C-1 y ácidos grasos no saturados esterificados en el C-2.
-Los principales glicerofosfolípidos de membrana en Escherichia coli son fosfatidil-etanolamina y fosfatidilglicerol.
-Para determinar las estructuras y las identidades de sus ácidos grasos individuales se puede usar una diversidad de fosfolipasas.
- Las posiciones específicas de ácidos grasos en los glicerofosfolípidos se pueden determinar usando fosfolipasa A1 y fosfolipasa A2, que catalizan en forma específica.
La fosfolipasa A2
-Es la principal en el jugo pancreático, y es la responsable de la digestión de fosfolípidos de membrana.
-También está presente en los venenos de víbora,
abeja y avispa.
Altas concentraciones de los productos de la fosfolipasa A2 pueden romper las membranas celulares. Así, la inyección de veneno de víbora en la sangre puede causar lisis de las membranas de los glóbulos rojos que puede poner en peligro la
vida.
La fosfolipasa C cataliza la hidrólisis del enlace P—O entre glicerina y fosfato, para liberar diacilglicerol, y la fosfolipasa D convierte los glicerofosfolípidos en fosfatidatos.
Esfingolípidos
- Después de los glicerofosfolípidos, los lípidos más abundantes en las membranas vegetales y animales son ellos.
- El respaldo estructural de los esfingolípidos es la esfingosina (trans-4-esfingenina).
La Ceramida
- Está formada por un grupo acilo graso unido al grupo amino del C-2 en la esfingosina,por un enlace de amida.
- Las ceramidas son los precursores metabólicos de todos los esfingolípidos.
Las tres grandes familias de esfingolípidos son las:
Esfingomielinas:
La fosfocolina está unida al grupo hidróxido en el C-1 de una ceramida.
 existen en las membranas plasmáticas de la mayor parte de las células de mamíferos, y son componente principal de las vainas de mielina que rodean a ciertas células nerviosas.
existen en las membranas plasmáticas de la mayor parte de las células de mamíferos, y son componente principal de las vainas de mielina que rodean a ciertas células nerviosas.Los cerebrósidos:
- Son glicoesfingolípidos que contienen un residuo de monosacárido unido a un enlace b-glicosídico al C-1 de una ceramida.
- Los galactocerebrósidos, llamados también galactosilceramidas, tienen un solo residuo de b-D-galactosilo como grupo de cabeza polar.
Los gangliósidos:
- Son glicoesfingolípidos más complejos, donde las cadenas de oligosacárido que contienen ácido N-acetilneuramínico (NeuNAc) están unidas a una ceramida.
- El NeuNAc es un derivado acetilado del carbohidrato ácido siálico, y forma los grupos de cabeza en gangliósidos aniónicos.
- Se han caracterizado más de 60 variedades de gangliósidos.
- Su diversidad estructural se debe a variaciones en la composición y la secuencia de los residuos de azúcar.
- Están en las superficies celulares, con las dos cadenas de hidrocarburo de la mitad de ceramida incrustadas en la membrana plasmática, y los oligosacáridos en la superficie extracelular.
Los cerebrósidos y los gangliósidos contienen residuos de carbohidrato y se clasifican como glicoesfingolípidos.
Esteroides
- Los esteroides son una tercera clase de lípidos que se encuentran en las membranas de los eucariotas, y muy rara vez en las bacterias.
- Los esteroides, junto con las vitaminas lipídicas y los terpenos, se clasifican como isoprenoides porque sus estructuras se relacionan con la molécula de isopreno, de cinco carbono.
- Los esteroides contienen cuatro anillos fundidos, tres de seis carbonos identificados como A, B y C, y un anillo D de cinco carbonos.
- La estructura anular característica se deriva del escualeno.
-El colesterol se acumula con frecuencia en depósitos lipídicos (placas) en las paredes de los vasos sanguíneos.
-Se han identificado esas placas en las enfermedades cardiovasculares, que pueden provocar ataques al corazón.
.A pesar de su implicación en enfermedades cardiovasculares, el colesterol tiene
participación esencial en la bioquímica de los mamíferos.
-No sólo es un componente de ciertas membranas, sino también un precursor esencial de las hormonas esteroides y de las sales biliares.
Otros lípidos de importancia biológica
Hay muchas clases de lípidos que no se encuentran en las membranas. Incluyen distintos compuestos:
Ceras:
 |
| Éster de palmitato |
- Son ésteres no polares de ácidos grasos de cadena larga y alcoholes monohidroxílicos de cadena larga. Por ejemplo, el palmitato de miricilo, uno de los principales componentes de la cera de abejas, es el éster de palmitato.
- Las ceras están muy distribuidas en la naturaleza.
- Proporcionan cubiertas protectoras impermeables a las hojas y frutos de ciertas plantas, y en la piel, cuero, plumas y exoesqueletos de animales.
Eicosanoides:
- Son derivados oxigenados de ácidos grasos poliinsaturados de de C20, como ácido araquidónico.
- Éstos participan en una diversidad de procesos fisiológicos, y también pueden mediar muchas respuestas potencialmente patológicas.
- Las prostaglandinas son eicosanoides que tienen un anillo de ciclopentano. La prostaglandina E2 puede causar constricción de vasos sanguíneos, y el tromboxano A2 interviene en la formación de coágulos sanguíneos, que en algunos casos pueden bloquear el flujo de sangre al corazón o al cerebro. El leucotrieno D4, mediador de la contracción de músculos lisos, también provoca la constricción bronquial de los asmáticos. La aspirina (ácido acetilsalicílico) alivia el dolor, la fiebre, la hinchazón y la inflamación, al inhibir la síntesis de las prostaglandina
Algunos isoprenoides
- Algunos de los lípidos no de membrana se relacionan con el isopreno, pero no son esteroides.
- Las vitaminas lipídicas A, E y K son isoprenoides que contienen largas cadenas de hidrocarburo o anillos fundidos.
- La vitamina D es un isoprenoide derivado del colesterol. Hay varios carotenos relacionados con el retinol (vitamina A).
- El limoneno es un terpeno, lípido cíclico que principalmente es responsable del olor característico de los limones. Otros isoprenoides son el bactoprenol y la hormona juvenil.
Las membranas biológicas están formadas
por bicapas lipídicas y proteínas
- Las membranas biológicas no sólo son barreras pasivas contra la difusión.
- Tienen una gran variedad de funciones complejas. Algunas proteínas contenidas en las membranas sirven como bombas selectivas que controlan en forma estricta el transporte de iones y de moléculas pequeñas que entran y salen de la célula.
- Las membranas también son responsables de generar y mantener la concentración de gradientes de protones, esenciales para la producción de ATP.
- En el estudio de los lípidos deben usarse técnicas no acuosas especiales.
Bicapas lipídicas
 Igual que los detergentes, los glicerofosfolípidos y los glicoesfingolípidos anfipáticos pueden formar monocapas bajo ciertas condiciones. En las células, esos lípidos no se empacan bien en las micelas, sino más bien tienden a formar bicapas lipídicas.
Igual que los detergentes, los glicerofosfolípidos y los glicoesfingolípidos anfipáticos pueden formar monocapas bajo ciertas condiciones. En las células, esos lípidos no se empacan bien en las micelas, sino más bien tienden a formar bicapas lipídicas.
Las bicapas lipídicas son el principal componente estructural de todas las membranas biológicas, incluyendo membranas plasmáticas y membranas internas de células eucariotas.
Una bicapa lipídica tiene en forma típica de 5 a 6 nm de espesor, y consiste en dos hojas o monocapas (que también se llaman hojillas). En cada hoja, los grupos polares de cabeza en los lípidos anfipáticos están en contacto con el medio acuoso, y las colas no polares de hidrocarburos apuntan hacia el interior de la bicapa.
Modelo fluido de mosaico para membranas biológicas:
Una membrana biológica típica contiene de un 25 a un 50% de lípidos, y de un 50 a un 75% de proteínas, en masa, con menos de 10% de carbohidratos como componente de glicolípidos y glicoproteínas. Los lípidos son una mezcla compleja de fosfolípidos, glicoesfingolípidos (en animales) y colesterol (en algunos eucariotas).
Una membrana biológica es más gruesa que una bicapa lipídica: en forma típica tiene de 6 a 10 nm de espesor. S. Jonathan Singer y Garth L. Nicolson propusieron en 1972 el modelo de mosaico fluido y todavía tiene validez general para describir el arreglo de lípidos y proteínas dentro de una membrana. Según el modelo del mosaico fluido, la membrana es una estructura dinámica en la que se pueden difundir lateralmente o girar dentro de la bicapa, en forma rápida y aleatoria, las proteínas y los lípidos. Las proteínas de membrana se conciben como témpanos de hielo flotando en un mar muy fluido de bicapa lipídica.
Las bicapas lipídicas y las membranas son estructuras dinámicas
Los lípidos en una bicapa están en movimiento constante, dando a las bicapas lipídicas
muchas de las propiedades de los fluidos.
Los lípidos tienen varios tipos de movimiento molecular dentro de las bicapas.
El rápido movimiento de los lípidos dentro del plano de una monocapa es un ejemplo de difusión lateral bidimensional.
Una molécula de fosfolípido se puede difundir de un extremo a otro de una célula bacteriana (una distancia aproximada de 2 mm) en 1 s más o menos a 37 °C. En contraste, la difusión transversal es el paso de lípidos de una monocapa de la bicapa a la otra. La difusión transversal es mucho más lenta que la lateral.
 | ||
| La difusión lateral de los lípidos es relativamente rápida. | la difusión transversal, o basculante, de los lípidos, es muy lenta. |
 La distribución de las proteínas de membrana se puede visualizar por microscopia electrónica de criofractura.
La distribución de las proteínas de membrana se puede visualizar por microscopia electrónica de criofractura.
En esta técnica se congela rápidamente una muestra de membrana, hasta la temperatura de nitrógeno líquido, y a continuación se rompe con
una cuchilla. La membrana se divide entre las hojillas de la bicapa lipídica, donde las interacciones intermoleculares son más débiles.
 Se evapora el hielo al vacío y la superficie interna expuesta se recubre a continuación con una película delgada de platino, para obtener una réplica metálica que se examina en un microscopio electrónico.
Se evapora el hielo al vacío y la superficie interna expuesta se recubre a continuación con una película delgada de platino, para obtener una réplica metálica que se examina en un microscopio electrónico.Tres clases de proteínas de membrana
Según su modo de asociación con la bicapa lipídica: proteínas integrales de membrana, proteínas periféricas de membrana y proteínas de membrana ancladas a lípidos.
Las proteínas integrales de membrana
-Llamadas también proteínas transmembranales, contienen regiones hidrofóbicas incrustadas en el interior hidrofóbico de la bicapa lipídica .
-Abarcan totalmente a la bicapa con una parte de la proteína expuesta sobre la superficie externa, y una parte expuesta en la superficie interna.
-Una de las proteínas integrales de membrana mejor caracterizadas es la bacteriorrodopsina. Esta proteína se encuentra en la membrana citoplásmica de la bacteria halofílica (amante de la sal) Halobacterium halobium, donde ayuda a controlar la energía luminosa que se usa en la síntesis del ATP. La bacteriorrodopsina consiste en un haz de siete a hélices.
Las proteínas periféricas de membrana se asocian a una cara de la membrana, mediante interacciones de carga a carga y con puentes de hidrógeno, con las proteínas integrales de membrana o con los grupos de cabeza polar de los lípidos de membrana.
Las proteínas de membrana ancladas a lípidos están unidas a una membrana mediante un enlace covalente con un ancla lipídico.
-Las células vivas mueven a las sustancias polares y iónicas a través de las
membranas usando proteínas de transporte (que a veces se les llama portadoras, permeasas o traslocadoras)
-Los gases no polares, como el O2 y el CO2, y las moléculas hidrofóbicas, como las de esteroides, vitaminas lipídicas y algunos medicamentos, entran y salen de la célula difundiéndose a través de la membrana, pasando del lado con mayor concentración al lado de menor concentración. Las proteínas integrales de membrana
-Llamadas también proteínas transmembranales, contienen regiones hidrofóbicas incrustadas en el interior hidrofóbico de la bicapa lipídica .
-Abarcan totalmente a la bicapa con una parte de la proteína expuesta sobre la superficie externa, y una parte expuesta en la superficie interna.
-Una de las proteínas integrales de membrana mejor caracterizadas es la bacteriorrodopsina. Esta proteína se encuentra en la membrana citoplásmica de la bacteria halofílica (amante de la sal) Halobacterium halobium, donde ayuda a controlar la energía luminosa que se usa en la síntesis del ATP. La bacteriorrodopsina consiste en un haz de siete a hélices.
Las proteínas periféricas de membrana se asocian a una cara de la membrana, mediante interacciones de carga a carga y con puentes de hidrógeno, con las proteínas integrales de membrana o con los grupos de cabeza polar de los lípidos de membrana.
Las proteínas de membrana ancladas a lípidos están unidas a una membrana mediante un enlace covalente con un ancla lipídico.
Transporte de membrana
-Las membranas son barreras de permeabilidad selectiva que restringen el paso libre de la mayor parte de las moléculas. Sin embargo, las de agua, oxígeno y otras pequeñas deben poder entrar a todas las células y moverse libremente entre los compartimientos en el interior de las células eucariotas.
Las moléculas más grandes, como las de proteínas y ácidos nucleicos, también deben transportarse atravesando las membranas, incluyendo las que hay entre compartimientos. -Las células vivas mueven a las sustancias polares y iónicas a través de las
membranas usando proteínas de transporte (que a veces se les llama portadoras, permeasas o traslocadoras)
El tráfico de moléculas polares y de iones a través de las membranas es mediado por tres tipos de proteínas integrales de membrana: canales y poros, transportadores pasivos y transportadores activos
Poros y canales
- Son proteínas transmembranales con un paso central para iones y moléculas pequeñas. (En general, el término poro se usa en las bacterias, y canal para los animales).
- Los solutos con tamaño, carga y estructura molecular adecuados pueden atravesar rápidamente el pasaje en cualquier dirección, difundiéndose a favor de un gradiente de concentración. En este proceso no se requiere energía
- Las membranas de los tejidos nerviosos tienen canales de potasio con compuerta (es decir, controlados), que en forma selectiva permiten el transporte de iones potasio hacia el exterior. Estos canales permiten que los iones K atraviesen la membrana al menos 10 000 veces más rápido que los iones Na, que son más pequeños.
- Al parecer, los iones sodio conservan más agua de hidratación y por consiguiente transitan con mucha más lentitud por el filtro. El resto del canal tiene un recubrimiento hidrofóbico.
Transporte pasivo:
- En el transporte pasivo, el soluto se mueve a favor de su gradiente de concentración, y el potencial de membrana es favorable.
- Entonces, el cambio de energía libre de Gibbs para el transporte es negativo, y el transporte de un lado a otro de la membrana es un proceso espontáneos.
Los transportadores de membrana más simples, sean activos o pasivos, realizan uniporte; esto es, sólo llevan un solo tipo de soluto a través de la membrana..

Si ambas moléculas se transportan en la misma dirección, el proceso se llama simporte.

Si se transportan en direcciones opuestas, el proceso es antiporte.
Transporte activo
- Se parece al transporte pasivo en el mecanismo y propiedades cinéticas generales. Sin embargo, el transporte activo requiere energía para mover un soluto contra su gradiente de concentración.
- En algunos casos, el transporte activo de moléculas o iones cargados causa también un gradiente de carga a través de la membrana, y el transporte activo mueve los iones contra el potencial de membrana.
- Los transportadores activos usan diversas fuentes de energía, con más frecuencia ATP. Las ATPasas transportadoras de iones se encuentran en todos los organismos.
El transporte activo secundario está impulsado por un gradiente de concentración. El transporte cuesta arriba activo de un soluto se acopla con el transporte cuesta abajo de un segundo soluto que estaba concentrado por el transporte activo primario.
Endocitosis y exocitosis
- El transporte descrito hasta ahora sucede por el flujo de moléculas o iones a través de una membrana intacta.
- En las células eucariotas, aunque no en todas, las proteínas (y ciertas sustancias grandes) se mueven hacia adentro y afuera de la célula por endocitosis y exocitosis.
- El transporte implica la formación de un tipo especializado de vesícula lipídica.
- La endocitosis comienza con la unión de macromoléculas a la membrana plasmática de la célula. A continuación la membrana se invagina y forma una vesícula que contienen las moléculas enlazadas. El interior de la vesícula es topológicamente equivalente al exterior de la célula.
- La exocitosis se parece a la endocitosis, pero la dirección del transporte es la inversa. Durante la exocitosis, los materiales destinados a ser secretados de la célula se encierran En vesículas mediante el aparato de Golgi. A continuación las vesículas se funden con la membrana plasmática y liberan su contenido al espacio extracelular.
Utilización en La Farmacia
1. Gran número de aceites vegetales se usan como excipientes.
2. Sustancias incorporadas a ciertos productos como vehículo para la asimilación corporal de
principios activos, y aunque éstos no surgen efecto por sí solos, aceites como el de almendra,
aguacate, café y almendra se utilizan para dicho propósito.
3. De fuentes animales solo es posible utilizar aceites de pescado y aves para lograr la propiedad
excipiente.
4. Los fosfolipidos son lípidos con un extremo cargado negativamente debido al grupo fosfato y
tienen largas cadenas hidrofóbicas; se aplican principalmente en medicamentos, y son muy
empleados en pacientes con el síndrome de inmunodeficiencia adquirida (SIDA), aunque sus usos
deben ser moderados ya que sus efectos son fuertes y pueden llegar a causar daños severos si no
se trata de manera adecuada.
5. Gran numero de excipientes.
por ejemplo:
Los ácidos grasos Omega 3 pertenecen a una clase de medicamentos llamados antilipémicos o
agentes reguladores de lípidos. Los ácidos grasos Omega 3 pueden funcionar al disminuir la
cantidad de triglicéridos y otras grasas que se producen en el hígado.
agentes reguladores de lípidos. Los ácidos grasos Omega 3 pueden funcionar al disminuir la
cantidad de triglicéridos y otras grasas que se producen en el hígado.
Utilización:
Los ácidos grasos Omega 3 se utilizan junto con los cambios en el estilo de vida
(dieta, pérdida de peso, ejercicio) para reducir la cantidad de triglicéridos (una sustancia parecida
a la grasa) en la sangre de las personas que tienen niveles muy altos de triglicéridos.
¿Como se debe utilizar este medicamento?
Los ácidos grasos omega 3 con receta medica como esteres etilicos del acido omega 3 (Lovaza
Omytrg, esteres etilicos icosapent (vascepa) y acidos carboxilos de omega 3 (Epanova) vienen en
presentacion de capsula de gel rellena de liquido para tomar por vía oral.
Usualmente Epanova se toma una vez al día con o sin alimentos.
Lovaza con frecuencia se toma una o dos veces al dia con o sin alimentos.
Usualmente Omytrg se toma una o dos veces al dia con alimentos. con frecuencia Vasepa se
toma dos veces a dia con alimentos.
siga atentamente las instrucciones que se encentran en la etiqueta de su receta medica o en el
paquete y pida a su farmacéutico o medico que le explique cualquier cualquier parte que no
comprenda.
Trague las capsulas enteras; nos la divida, triture, mastique, ni disuelva. si no puede tragar las
capsulas enteras avise a su medico.
Los ácidos grasos Omega 3 se utilizan junto con los cambios en el estilo de vida
(dieta, pérdida de peso, ejercicio) para reducir la cantidad de triglicéridos (una sustancia parecida
a la grasa) en la sangre de las personas que tienen niveles muy altos de triglicéridos.
¿Como se debe utilizar este medicamento?
Los ácidos grasos omega 3 con receta medica como esteres etilicos del acido omega 3 (Lovaza
Omytrg, esteres etilicos icosapent (vascepa) y acidos carboxilos de omega 3 (Epanova) vienen en
presentacion de capsula de gel rellena de liquido para tomar por vía oral.
Usualmente Epanova se toma una vez al día con o sin alimentos.
Lovaza con frecuencia se toma una o dos veces al dia con o sin alimentos.
Usualmente Omytrg se toma una o dos veces al dia con alimentos. con frecuencia Vasepa se
toma dos veces a dia con alimentos.
siga atentamente las instrucciones que se encentran en la etiqueta de su receta medica o en el
paquete y pida a su farmacéutico o medico que le explique cualquier cualquier parte que no
comprenda.
Trague las capsulas enteras; nos la divida, triture, mastique, ni disuelva. si no puede tragar las
capsulas enteras avise a su medico.
Aceite de hígado de Bacalao
También llamado oleum morrhuae, es como su nombre indica aceite extraído de
hígados de bacalao del Atlántico (Gadus morhua).
Es un suplemento dietético, suministrado comúnmente en el pasado a los niños. El aceite de
hígado de bacalao es uno de los proveedores más eficaces de ácidos grasos omega 3 (EPA y
DHA) y se toma con frecuencia para aliviar el dolor y la rigidez articular relacionada con la
artritis, si bien también se ha demostrado clínicamente que tiene un efecto positivo sobre la salud
del corazón, los huesos y el cerebro, así como para mejorar la piel, el pelo y las uñas
Características
Es una fuente de vitamina A y de D. Dependiendo de su calidad, el sabor y aroma varía desde un
suave sabor similar al de las sardinas hasta un intenso y molesto olor a pescado podrido y aceite
rancio. El aceite de hígado de bacalao de alta calidad es un líquido oleoso amarillo pálido poco
espeso con un olor peculiar ligeramente a pescado, pero no rancio, y un sabor suave también
ligeramente a pescado.
ACIDOS NUCLEICOS

Los ácidos nucleicos son polinucleótidos, o polímeros de nucleótidos.
Los nucleótidos tienen tres componentes: un azúcar con cinco carbonos, uno o más grupos fosfato y un compuesto nitrogenado débilmente básico llamado base.
- Las bases que se encuentran en los nucleótidos son pirimidinas y purinas sustituidas.
- La pentosa suele ser ribosa (D-ribofuranosa) o 2-desoxirribosa (2-desoxi-D-ribofuranosa)
- Los N-glicósidos pirimidinas o purina de estos azúcares se llaman nucleósidos.
- Los nucleótidos son los ésteres de fosfato de los nucleósidos; los nucleótidos comunes contienen uno a tres grupos fosforil
- Los nucleótidos que contienen ribosa se llaman ribonucleótidos, y los que contienen desoxirribosa se llaman desoxirribonucleóticos.
Ribosa y desoxirribosa
- Los dos azúcares aparecen como proyecciones de Haworth de la configuración b de las formas de anillo de furanosa. Cada uno de esos anillos de furanosa puede adoptar conformaciones diferentes.
Purinas y pirimidinas
Las estructuras de esos compuestos heterocíclicos, y los sistemas de numeración de los átomos de carbono y nitrógeno de cada base.
· Las principales pirimidinas que hay en los nucleótidos son Uracilo (2,4-dioxopirimidina, U), Timina (2,4-dioxo-5-metilpirimidina, T) y Citosina (2-oxo-4-aminopirimidina, C). Las principales purinas son Adenina (6-aminopurina, A) y guanina (2-amino-6-oxopurina, G).
Las estructuras de esos compuestos heterocíclicos, y los sistemas de numeración de los átomos de carbono y nitrógeno de cada base.
· La pirimidinas tiene un solo anillo de cuatro átomos de carbono y dos de nitrógeno.
· La purina tiene un sistema de anillos fundidos de pirimidinas y de imidazol. Los dos tipos de bases son no saturados, con dobles enlaces conjugados. Esta propiedad hace que los anillos sean planos, y también explica su capacidad de absorber la luz ultravioleta.
· Las purinas y pirimidinas sustituidas son ubicuas en las células vivas.
· Las principales pirimidinas que hay en los nucleótidos son Uracilo (2,4-dioxopirimidina, U), Timina (2,4-dioxo-5-metilpirimidina, T) y Citosina (2-oxo-4-aminopirimidina, C). Las principales purinas son Adenina (6-aminopurina, A) y guanina (2-amino-6-oxopurina, G).
· La Adenina, la guanina y la Citosina están en ribonucleótidos y desoxirribonucleóticos. El Uracilo se encuentra principalmente en ribonucleótidos y la Timina en desoxirribonucleóticos.
· Las purinas y las pirimidinas son bases débiles relativamente insolubles en agua al pH fisiológico. Sin embargo, dentro de las células la mayor parte de bases pirimidinas y purina se encuentran como constituyentes de nucleótidos y polinucleótidos, compuestos que son muy hidrosolubles.
· Todas las bases en los nucleótidos comunes pueden participar en puentes de hidrógeno. Los grupos amino de la Adenina y la Citosina son donadores de hidrógeno y los átomos de nitrógeno en el anillo (N-1 en la Adenina y N-3 en la Citosina) son aceptores de hidrógeno.
· La guanina, la Citosina y la Timina pueden formar tres puentes de hidrógeno.
Purinas
Pirimidas
Nucleósidos
1. Los nucleósidos están formados por ribosa y desoxirribosa y una base heterocíclica. En cada nucleósidos, un enlace b-N-glicosídico conecta el C-1 del azúcar al N-1 de la pirimidinas o al N-9 de la purina.
v Conformaciones sis y anti. La forma anti suele ser más estable en los nucleósidos de pirimida.
1. Los nucleósidos están formados por ribosa y desoxirribosa y una base heterocíclica. En cada nucleósidos, un enlace b-N-glicosídico conecta el C-1 del azúcar al N-1 de la pirimidinas o al N-9 de la purina.
2. Los nombres de los nucleósidos se derivan de los de sus bases. El ribonucleótidos que contiene Adenina se llama Adenosina.
3. Su contraparte desoxi se llama desoxiadenosina. De igual modo, los ribonucleósidos de guanina, Citosina y Uracilo son Guanosina, Citidina y uridina, respectivamente. Los desoxirribonucleósidos de guanina, Citosina y Timina son desoxiguanosina, desoxicitidina y desoxitimidi.
4. También por lo común se usan las abreviaturas de una sola letra para las bases de pirimidinas y purina para designar a los ribonucleósidos: A, G, C y U para Adenosina, Guanosina, Citidina y uridina, respectivamente. Los desoxirribonucleósidos se abrevian dA, dG, dC y dT, cuando es necesario distinguirlos de los ribonucleósidos.
v Conformaciones sis y anti. La forma anti suele ser más estable en los nucleósidos de pirimida.
Nucleótidos
El ADN tiene doble hebra
1. Hacia 1950 estaba claro que el ADN es un polímero lineal de residuos de 2-desoxirribonucleótido unidos por 3”,5” fosfodiésteres.
Unión de nucleótidos por enlaces de 3 primas ,5 primas fosfodiéster
1. La estructura primaria de un ácido nucleíco es la secuencia de sus residuos de nucleótido unidos por enlaces 3fosfodiéster.
Cada grupo fosfato que participa en un enlace fosfodiéster tiene un pKa aproximado
de 2, y una carga negativa a pH neutro.
1. Hacia 1950 estaba claro que el ADN es un polímero lineal de residuos de 2-desoxirribonucleótido unidos por 3”,5” fosfodiésteres.
2. En el ADN de todas las especies, la relación de purinas a pirimidinas siempre es 1:1.
3. El modelo de ADN propuesto por Watson y Crick en 1953 se basó en las estructuras conocidas de los nucleósidos.
4. El modelo de Watson-Crick explicó las cantidades iguales de purinas y pirimidinas al sugerir que el ADN tiene doble hebra (doble cadena) y que las bases en una hebra se apareaban en forma específica con las bases de la otra: A con T y G con C.
5. La estructura propuesta por Watson y Crick se llama hoy conformación B del ADN, o simplemente B-ADN.
6. El ADN es el almacén de la información biológica.
Unión de nucleótidos por enlaces de 3 primas ,5 primas fosfodiéster
1. La estructura primaria de un ácido nucleíco es la secuencia de sus residuos de nucleótido unidos por enlaces 3fosfodiéster.
2. Se dice que un extremo de una cadena lineal de polinucleótidos es 5 (porque no hay residuo unido a su carbono 5) y que el otro es 3 (porque no hay residuo unido a su átomo de carbono 3). Por convención, la dirección de una hebra de ADN se define leyendo los átomos que forman el residuo de azúcar. Así, al ir de arriba abajo de la hebra que quiere decir moverse en la dirección 3→ 5
Cada grupo fosfato que participa en un enlace fosfodiéster tiene un pKa aproximado
de 2, y una carga negativa a pH neutro.
Formación de una doble hélice con dos hebras anti paralelas
- La mayor parte de las moléculas de ADN consisten de dos hebras, de polinucleótidos.
- Cada una de las bases en una hebra forma puentes de hidrógeno con una base de la hebra opuesta.
- La guanina se aparea con Citosina y la Adenina con Timina, maximizando los puentes de hidrógeno entre sitios potenciales.
- Entonces, los pares de bases G/C tienen tres puentes de hidrógeno, y los pares de bases A/T tienen dos. Esta propiedad del ADN de doble hebra explica el descubrimiento de Chargaff, de que la relación de A con T y de G con C es 1:1 para una gran variedad de moléculas de ADN. Como A en una hebra se aparea con T en la otra, y G se aparea con C, las hebras son complementarias, y una puede servir como plantilla para la otra.
- Los esqueletos de azúcar-fosfato en las hebras complementarias de ADN de doble hebra tienen orientaciones opuestas. En otras palabras, son antiparalelas.
- En una representación tridimensional real, las dos cadenas se enrollan entre sí para formar una estructura helicoidal de doble hebra, o doble hélice.
- La molécula de ADN se puede visualizar como una “escalera” que se ha torcido para formar una hélice.
La doble hélice tiene dos surcos de ancho desigual, por la forma en que se apilan los pares de bases y en que se tuercen los esqueletos de azúcar-fosfato. Esos surcos se llaman surco mayor y surco menor.
- La mayor parte de las moléculas de ADN consisten de dos hebras, de polinucleótidos.
- Cada una de las bases en una hebra forma puentes de hidrógeno con una base de la hebra opuesta.
- La guanina se aparea con Citosina y la Adenina con Timina, maximizando los puentes de hidrógeno entre sitios potenciales.
- Entonces, los pares de bases G/C tienen tres puentes de hidrógeno, y los pares de bases A/T tienen dos. Esta propiedad del ADN de doble hebra explica el descubrimiento de Chargaff, de que la relación de A con T y de G con C es 1:1 para una gran variedad de moléculas de ADN. Como A en una hebra se aparea con T en la otra, y G se aparea con C, las hebras son complementarias, y una puede servir como plantilla para la otra.
- Los esqueletos de azúcar-fosfato en las hebras complementarias de ADN de doble hebra tienen orientaciones opuestas. En otras palabras, son antiparalelas.
- En una representación tridimensional real, las dos cadenas se enrollan entre sí para formar una estructura helicoidal de doble hebra, o doble hélice.
- La molécula de ADN se puede visualizar como una “escalera” que se ha torcido para formar una hélice.
La doble hélice tiene dos surcos de ancho desigual, por la forma en que se apilan los pares de bases y en que se tuercen los esqueletos de azúcar-fosfato. Esos surcos se llaman surco mayor y surco menor.
Superenrollamiento del ADN
1. Una molécula circular de ADN con la conformación B tiene un promedio de 10.4 pares de bases por vuelta. Se dice que está relajada si tal molécula puede reposar plana sobre una superficie.
La molécula de ADN a la izquierda es un círculo cerrado relajado, y tiene la conformación B normal. Al romper la hélice de ADN y desenrollarla dos vueltas antes de volver a formar el círculo se producen dos superenrollamientos. Estos superenrollamientos compensan el desenvolvimiento y restauran la conformación normal B. La molécula de la derecha tiene una región de ADN no enrollada localmente. Esta conformación equivale topológicamente a ADN superenrollado en forma negativa.
1. Una molécula circular de ADN con la conformación B tiene un promedio de 10.4 pares de bases por vuelta. Se dice que está relajada si tal molécula puede reposar plana sobre una superficie.
La molécula de ADN a la izquierda es un círculo cerrado relajado, y tiene la conformación B normal. Al romper la hélice de ADN y desenrollarla dos vueltas antes de volver a formar el círculo se producen dos superenrollamientos. Estos superenrollamientos compensan el desenvolvimiento y restauran la conformación normal B. La molécula de la derecha tiene una región de ADN no enrollada localmente. Esta conformación equivale topológicamente a ADN superenrollado en forma negativa.
Diversos tipos de ARN en las células
1. ARN ribosómico (ARNr); moléculas que son parte integral de los ribosomas (ribonucleoproteína intracelulares que son sitios de síntesis de proteínas). El ARN ribosómico es la clase más abundante de ácido ribonucleico, que forma 80% del ARN celular total.
1. ARN pequeño; moléculas presentes en todas las células. Algunas moléculas pequeñas de ARN tienen actividad catalítica o contribuyen a la actividad catalítica, asociadas a proteínas. Muchas de esas moléculas de ARN se relacionan con eventos de procesamiento que modifican al ARN después de que se ha sintetizado.
Nucleosomas
1. ARN ribosómico (ARNr); moléculas que son parte integral de los ribosomas (ribonucleoproteína intracelulares que son sitios de síntesis de proteínas). El ARN ribosómico es la clase más abundante de ácido ribonucleico, que forma 80% del ARN celular total.
2. El ARN de transferencia (ARNt); son moléculas que llevan a los aminoácidos activados a los ribosomas para su incorporación a las cadenas de péptidos en crecimiento durante la síntesis de proteínas. Las moléculas de ARNt sólo tienen de 73 a 95 residuos de nucleótidos de longitud. Forman un 15% del ARN celular total.
3. ARN mensajero (ARNm); moléculas que codifican las secuencias de aminoácidos en las proteínas. Son los “mensajeros” que llevan la información del ADN al complejo de traducción, donde se sintetizan las proteínas. En general, el ARNm sólo forma el 3% del ARN celular total. Estas moléculas son las menos estables de los ácidos ribonucleicos celulares.
1. ARN pequeño; moléculas presentes en todas las células. Algunas moléculas pequeñas de ARN tienen actividad catalítica o contribuyen a la actividad catalítica, asociadas a proteínas. Muchas de esas moléculas de ARN se relacionan con eventos de procesamiento que modifican al ARN después de que se ha sintetizado.
Nucleosomas
1. Las proteínas principales de la cromatina se llaman histonas. La mayoría de las especies eucarióticas tienen cinco histonas distintas, llamadas H1, H2A, H2B, H3 y H4. Las cinco histonas son proteínas pequeñas y básicas, que contienen numerosos residuos de lisina y arginina, cuyas cargas positivas permiten que las proteínas se unan al esqueleto de azúcar-fosfato, con carga negativa, del ADN.
Diagrama de la estructura del nucleosomas. a) Octámero de las histonas. b) Nucleosomas.
Cada nucleosoma está formado por una Partícula central más histona H1 y ADN de enlace. La partícula central del nucleosoma está formada por un Octámero de histona y aproximadamente 146 pares de bases.
ARN polimerasa
La ARN polimerasa es una ARN nucleotidiltransferasa. Su función es llevar a cabo la transcripción. Realiza una copia de ADN a ARN catalizando la formación de los enlaces fosfodiester entre ribonucleótidos. La copia la hace nucleótido a nucleótido, usando ribonucleósidos trifosfato (rNTP). En el ARN el ribonucleótido Uracilo sustituye a la Timina del ADN.
Medicamentos que pose ácidos nucleicos
ADEFOVIR dipivoxilo
El adefovir se usa para tratar la infección de hepatitis B crónica (hinchazón del hígado causado por un virus) en los pacientes que tienen síntomas de la enfermedad. El adefovir pertenece a una clase de medicamentos llamados análogos nucleótidos. Funciona al reducir la cantidad de virus de la hepatitis B (HBV) en el cuerpo. El adefovir no cura la hepatitis B y no puede prevenir las complicaciones de la hepatitis B crónica como la cirrosis del hígado o el cáncer hepático. El adefovir no puede prevenir la propagación de la hepatitis B a otras personas.
¿ ¿Cómo se debe usar este medicamento?
- cefalea (dolor de cabeza)
- diarrea
- gases
- indigestión
- tos
- dolor de garganta
- secreción nasal
Estructura Química
 Dosis
La Zidovudina siendo un inhibidor nucleósidos de transcriptasa inversa es considerada como eje básico de la terapia antiretroviral. Las dosis recomendadas están disponibles para niños mayores de 6 semanas de edad.
Dosis
La Zidovudina siendo un inhibidor nucleósidos de transcriptasa inversa es considerada como eje básico de la terapia antiretroviral. Las dosis recomendadas están disponibles para niños mayores de 6 semanas de edad.
La AZT puede causar efectos adversos graves como daños en el hígado, toxicidad en la sangre y desórdenes musculares, además de otros efectos leves como nauseas, dolor de cabeza, cambios en la grasa corporal y decoloración de los dedos de las manos y pies.
Comentario de los vídeos:
La replicación se lleva a cabo gracias a la ADN polimerasa III, esta enzima cataliza la unión de los desoxinucleótidos trifosfato que son abundantes en el fluido del núcleo celular.
Durante el proceso de replicación, una de las cadenas madre se lee “bien” (en sentido 3`→ 5`) y, por lo tanto, la nueva cadena se sintetiza de corrido (hebra conductora), pero la otra está dispuesta en sentido contrario al que la polimerasa puede leer (hebra retardada).
Pasos:
- Apertura de la doble hélice del ADN por acción de las helicasas.
- Sintesis de los cebadores para que la ADN polimerasa pueda actuar. Las enzimas implicadas denominan primasas.
- Se inicia la polimerización por acción de la ADN polimerasa III
- Cuando se alcanza el cebador del fragmento sintetizado anteriormente la Polimerasa I sustituye a la Pol III y, haciendo uso simultáneo de sus actividades 111 Tema 10. Replicación, transcripción y traducción Bioquímica exonucleasa (degradadadora de nucleótidos) y polimerasa, va sustituyendo los cebadores por el ADN correspondiente.
- Las ligasas cierran las mellas que hay entre cada dos fragmentos.
Transcripción:
La transcripción consiste en la formación de una molécula de ARN a partir de la información genética contenida en un segmento de ADN. Es decir da lugar ana copia de ARN con secuencia complementaria y antiparalela, a partir de una secuencia molde en una de las hebras del ADN.
El mensajero que codifica la secuencia de aminácidos de uno o más polipéptidos especificados por un gen. El ARN trasnferente que lee la información codificada en el ARNm y transfiere el amoniácido adecuado a la cadena polipéptidica en crecimiento durante la síntesis proteica y el ARN ribosómico que forma parte de los ribosomas, las complejas maquinarias celulares donde se sintetizan las proteínas.
Traducción:
La traducción es un proceso muy complejo con un elevado coste energético (consume el 90% de la energía de la biosíntesis) y con necesidad de una estrecha de regulación. Es sin duda el proceso de síntesis en que participa mayor número de macromeléculas diferentes. Las principales son:
Al menos 32 tipos de ARNt portadores de aminoácidos .
Ribosomas (formados por unas 70 proteinas y 5 ARNr difentes) .
Un ARNm molde .
Mas de una docena de enzimas y factores proteicos adicionales para asistir al inicio, elongación y terminación .
Unas 100 proteinas adicionales para la modificación de las distintas proteinas
La ARN polimerasa es una ARN nucleotidiltransferasa. Su función es llevar a cabo la transcripción. Realiza una copia de ADN a ARN catalizando la formación de los enlaces fosfodiester entre ribonucleótidos. La copia la hace nucleótido a nucleótido, usando ribonucleósidos trifosfato (rNTP). En el ARN el ribonucleótido Uracilo sustituye a la Timina del ADN.
Medicamentos que pose ácidos nucleicos
ADEFOVIR dipivoxilo
El adefovir se usa para tratar la infección de hepatitis B crónica (hinchazón del hígado causado por un virus) en los pacientes que tienen síntomas de la enfermedad. El adefovir pertenece a una clase de medicamentos llamados análogos nucleótidos. Funciona al reducir la cantidad de virus de la hepatitis B (HBV) en el cuerpo. El adefovir no cura la hepatitis B y no puede prevenir las complicaciones de la hepatitis B crónica como la cirrosis del hígado o el cáncer hepático. El adefovir no puede prevenir la propagación de la hepatitis B a otras personas.
¿ ¿Cómo se debe usar este medicamento?
El adefovir viene envasado en forma de un comprimido para tomar por vía oral. Por lo general se toma una vez al día con o sin alimentos. Tome el adefovir alrededor de la misma hora todos los días. Siga cuidadosamente las instrucciones en la etiqueta del medicamento y pregúntele a su doctor o farmacéutico cualquier cosa que no entienda. Use el medicamento exactamente como se indica. No use más ni menos que la dosis indicada ni tampoco más seguido que lo prescrito por su doctor.
¿ ¿Qué otro uso se le da a este medicamento?
Este medicamento también puede ser prescrito para otros usos; pídale más información a su doctor o farmacéutico.
¿Cuáles son los efectos secundarios que podría provocar este medicamento?
El adefovir puede provocar efectos secundarios. Dígale a su doctor si cualquiera de estos síntomas se vuelve severo o si no desaparece:
• debilidad
- cefalea (dolor de cabeza)
- diarrea
- gases
- indigestión
- tos
- dolor de garganta
- secreción nasal
Zidovudina, Azidotimidina o AZT
Estructura Química

Dosis
La Zidovudina siendo un inhibidor nucleósidos de transcriptasa inversa es considerada como eje básico de la terapia antiretroviral. Las dosis recomendadas están disponibles para niños mayores de 6 semanas de edad.
No existen reglas absolutas acerca de cuándo iniciar la toma de tratamiento antirretroviral.
Efectos adversos:
La AZT puede causar efectos adversos graves como daños en el hígado, toxicidad en la sangre y desórdenes musculares, además de otros efectos leves como nauseas, dolor de cabeza, cambios en la grasa corporal y decoloración de los dedos de las manos y pies.
Comentario de los vídeos:
La replicación se lleva a cabo gracias a la ADN polimerasa III, esta enzima cataliza la unión de los desoxinucleótidos trifosfato que son abundantes en el fluido del núcleo celular.
Durante el proceso de replicación, una de las cadenas madre se lee “bien” (en sentido 3`→ 5`) y, por lo tanto, la nueva cadena se sintetiza de corrido (hebra conductora), pero la otra está dispuesta en sentido contrario al que la polimerasa puede leer (hebra retardada).
Pasos:
- Apertura de la doble hélice del ADN por acción de las helicasas.
- Sintesis de los cebadores para que la ADN polimerasa pueda actuar. Las enzimas implicadas denominan primasas.
- Se inicia la polimerización por acción de la ADN polimerasa III
- Cuando se alcanza el cebador del fragmento sintetizado anteriormente la Polimerasa I sustituye a la Pol III y, haciendo uso simultáneo de sus actividades 111 Tema 10. Replicación, transcripción y traducción Bioquímica exonucleasa (degradadadora de nucleótidos) y polimerasa, va sustituyendo los cebadores por el ADN correspondiente.
- Las ligasas cierran las mellas que hay entre cada dos fragmentos.
Transcripción:
La transcripción consiste en la formación de una molécula de ARN a partir de la información genética contenida en un segmento de ADN. Es decir da lugar ana copia de ARN con secuencia complementaria y antiparalela, a partir de una secuencia molde en una de las hebras del ADN.
El mensajero que codifica la secuencia de aminácidos de uno o más polipéptidos especificados por un gen. El ARN trasnferente que lee la información codificada en el ARNm y transfiere el amoniácido adecuado a la cadena polipéptidica en crecimiento durante la síntesis proteica y el ARN ribosómico que forma parte de los ribosomas, las complejas maquinarias celulares donde se sintetizan las proteínas.
Traducción:
La traducción es un proceso muy complejo con un elevado coste energético (consume el 90% de la energía de la biosíntesis) y con necesidad de una estrecha de regulación. Es sin duda el proceso de síntesis en que participa mayor número de macromeléculas diferentes. Las principales son:
Al menos 32 tipos de ARNt portadores de aminoácidos .
Ribosomas (formados por unas 70 proteinas y 5 ARNr difentes) .
Un ARNm molde .
Mas de una docena de enzimas y factores proteicos adicionales para asistir al inicio, elongación y terminación .
Unas 100 proteinas adicionales para la modificación de las distintas proteinas